题目内容
【题目】氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)基态氮原子的价电子排布图是______________。
(2)B、N、O三种元素第一电离能从大到小的顺序是__________。
(3)NaNO2中氮原子的杂化方式是____________,阴离子的立体构型是__________。
(4)NF3的键角____________NH3的键角(填“<”“>”或“=”),原因是____________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含有_______mol配位键。
(6)安全气囊的设计原理为6NaN3+Fe2O3![]() 3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。
①该反应中元素的电负性由大到小的顺序是____________;
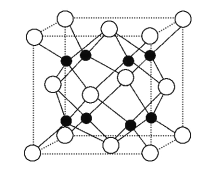
②Na2O的晶胞结构如图所示,晶胞边长为566 pm,晶胞中氧离子的配位数为____________,Na2O晶体的密度为________g·cm-3(只要求列算式,不必计算出结果)。
【答案】![]() N>O>B sp2 V形 < 氨中氮的周围电子云密度大斥力大,所以键角大,而NF3中氮周围三对成键电子云远离氮,斥力小,所以键角小 2mol O>N>Fe>Na 8 248/(NA×566×10-30)
N>O>B sp2 V形 < 氨中氮的周围电子云密度大斥力大,所以键角大,而NF3中氮周围三对成键电子云远离氮,斥力小,所以键角小 2mol O>N>Fe>Na 8 248/(NA×566×10-30)
【解析】
(1)氮原子的核电荷数为7,价电子为2s22p3;据此画出价电子排布图;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p轨道为半满稳定状态,第一电离能高于同周期相邻元素;据此分析;
(3)氮原子的孤电子对数为1,与之相连的氧原子有2,二者之和为1+2=3,则氮原子为sp2杂化,据此判断阴离子的空间构型;
(4)F元素电负性比H大, NF3中N周围电子云密度小于NH3中N周围电子云密度, 电子云密度大,斥力大,所以键角大,据此分析;
(5)NH4BF4中NH4+、BF4-均含有1个配位键,据此分析;
(6)非金属性越强,电负性越大,金属性越强,电负性越小,据此判断四种元素电负性大小;晶胞中白色球数目为8×1/8+6×1/2=4,黑色球数目为8,故白色球为O原子,黑色球为Na原子,根据原子配位数与原子数目成反比求出O原子配位数;先求出晶胞质量, 再根据ρ=m/V计算晶体密度。
(1)氮原子的核电荷数为7,核外电子排布为:1s22s22p3,价电子排布图是![]() ;综上所述,本题答案是:
;综上所述,本题答案是:![]() 。
。
(2) 同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p轨道为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能N>O>B;综上所述,本题答案是:N>O>B;
(3)氮原子的孤电子对数为1,与之相连的氧原子有2,二者之和为1+2=3,则氮原子为sp2杂化,由于氮原子含有1个孤电子对,所以NO2-的立体构型是V形;综上所述,本题答案是:sp2,V形。
(4)F元素电负性比H大, NF3中N周围电子云密度小于NH3中N周围电子云密度, 电子云密度大,斥力大,所以键角大,因此 NF3的键角< NH3的键角;因此,本题正确答案是: < ;氨中氮的周围电子云密度大斥力大,所以键角大,而NF3中氮周围三对成键电子云远离氮,斥力小,所以键角小。
(5) NH4BF4中NH4+、BF4-均含有1个配位键, 1 mol NH4BF4含有2mol配位键;因此,本题正确答案是:2mol。
(6)该反应中元素有:O、N、Fe、Na,非金属性越强,元素电负性越大,非金属性O>N,所以电负性O>N;金属性越强,元素电负性越小,金属性钠大于铁,所以电负性:Fe>Na;因此所以四种元素电负性大小顺序:O>N>Fe>Na;晶胞中白色球数目为8×1/8+6×1/2=4,黑色球数目为8,故白色球为O原子,黑色球为Na原子,钠原子配位数为4,而原子配位数与原子数目成反比,故O原子配位数为4×2=8;Na2O晶胞中含有4个Na2O,所以晶胞质量为4×62/NAg,则晶体密度[4×62/ NA]÷(566×10-10)3= 248/(NA×566×10-30);综上所述,本题答案是:O>N>Fe>Na;8;248/(NA×566×10-30)。

 高中必刷题系列答案
高中必刷题系列答案【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)。
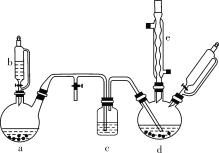
请回答下列问题:
(1)仪器b的名称是___。仪器a中盛有KMnO4晶体,仪器b盛有浓盐酸。打开仪器b的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是____,用离子方程式表示产生该现象的原因:_____
(2)仪器d内盛有苯、FeCl3粉末固体,仪器a中生成的气体经过仪器c进入仪器d中。仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是_____加热,其优点是________________。
(3)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3、HCl及部分Cl2,然后通过碱洗除去Cl2。碱洗后通过分液得到含氯苯的有机混合物,混合物成分及沸点如下表所示:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机混合物中提取氯苯时,采用蒸馏的方法,收集____℃左右的馏分。