题目内容
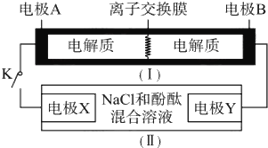
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为2K2S2+KI3![]() K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )
K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )
A. K+从左到右通过离子交换膜 B. 电极A上发生的反应为I3-+2e-=3I-
C. 电极Y上发生的反应为2Cl--2e-=Cl2↑ D. 当有0.1 molK+通过离子交换膜,X电极上产生1.12L气体(标准状况)
【答案】B
【解析】
当闭合开关K时,X附近溶液先变红,即X附近有氢氧根生成,所以在X极上得电子析出氢气,X极是阴极,Y极是阳极。与阴极连接的是原电池的负极,所以A极是负极,B极是正极。则
A、闭合K时,A是负极,B是正极,电子从A极流向B极,根据异性电荷相吸原理可知K+从左到右通过离子交换膜,A正确;
B、闭合K时,A是负极,负极上失电子发生氧化反应,电极反应式为2S22--2e-=S42-,B错误;
C、闭合K时,Y极是阳极,在阳极上溶液中的氯离子放电生成氯气,所以电极反应式为2Cl--2e-=Cl2↑,C正确;
D、闭合K时,当有0.1molK+通过离子交换膜,即有0.1mol电子产生,根据氢气与电子的关系式知,生成氢气的物质的量是0.05mol,体积为1.12L(标况下),D正确;
答案选B

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目