题目内容
1.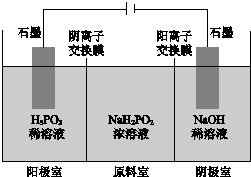 次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解
次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解NaH2PO2制H3PO2.(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)下列说法正确的是( )
| A. | 阳极室有H2生成 | B. | 阴极室溶液pH减小 | ||
| C. | 原料室溶液pH保持不变 | D. | 阳极室可能有H3PO4生成 |
分析 A、在该电解池的阳极上是氢氧根离子失电子的氧化反应,据此确定反应的产物;
B、该电解池的阴极上是得电子的还原反应,根据电极反应确定pH的变化;
C、次磷酸(H3PO2)是一元弱酸,NaH2PO2显示碱性,根据电解过程中离子的移动方向来判断pH的变化;
D、在阳极上是氢氧根离子浓度减小的反应,也是磷酸二氢根离子移向的电极,据此确定产物.
解答 解:A、该电解池的阳极上是氢氧根离子失电子的氧化反应,阳极室有O2生成,故A错误;
B、该电解池的阴极上是氢离子得电子的还原反应,氢离子浓度减小,所以溶液pH增大,故B错误;
C、次磷酸(H3PO2)是一元弱酸,NaH2PO2中因为阴离子的水解而导致溶液显示碱性,根据电解过程中磷酸二氢根离子移向阳极,所以原料室溶液pH减小,故C错误;
D、氢氧根离子在阳极放电,有氧气生成(有较强的氧化性),且水的电离平衡正向移动,氢离孑浓度增大,原料室中的次磷酸根离子(磷元素显+1价,有还原性)通过阴离子交换膜进入阳极室,与氢离子结合生成次磷酸( H3PO2),次磷酸(H3PO2)有可能被氧气(O2)氧化,生成磷酸( H3PO4),故D正确.
故选D.
点评 本题考查学生电解池的工作原理以及电极反应式的书写知识,注意知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
相关题目
12.下列说法不正确的是( )
| A. | 石油主要成分都是碳氢化合物 | |
| B. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| C. | 天然气和沼气的主要成分是甲烷 | |
| D. | 75%(体积分数)的乙醇溶液常用于医疗消毒 |
9.把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平).下列对该反应的说法不正确的是( )


| A. | IO4作氧化剂 | |
| B. | 若有1molMn2+参加反应转移5mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 配平后Mn2+、H+的化学计量数分别为2、3 |
16.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1某二元弱酸的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| B. | 某酸式盐NaHY的水溶液显碱性,该酸式盐溶液中离子浓度关系为:c(Na+)>c(HY-)>c(OH-)>c(H+) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 25℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
6.下列物质中,不存在化学键的是( )
| A. | 水 | B. | 食盐 | C. | 氯气 | D. | 氦气 |
13.将X、Y不论何种比例混合,只要其物质的量之和不变,完全燃烧时耗氧气量和生成水的物质的量也不变.X、Y可能是( )
| A. | C2H4、C2H6O | B. | C2H2、C6H6 | C. | CH2O、C3H6O2 | D. | CH4、C2H4O2 |
10.鉴定1,3-二氯丙烷中氯元素的存在,下列描述正确的是( )
| A. | 加入NaOH的溶液,加热,冷却后加入AgNO3溶液 | |
| B. | 加入NaOH溶液,加热,冷却后加入足量稀硝酸酸化,再加入AgNO3溶液 | |
| C. | 在氯乙烷中直接加入AgNO3溶液 | |
| D. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 |
11.化学与生活,社会密切相关.下列说法错误的是( )
| A. | 红葡萄酒密封储存时间越长,质量越好,原因之一是贮存过程中生成了有香味的酯 | |
| B. | 透过观察颜色容易区分黄金与铜锌合金 | |
| C. | 乙烯的产量可以用来衡量一个国家的石油化工发展水平 | |
| D. | 燃料电池是一种高效、环境友好的发电装置 |