��Ŀ����
����Ŀ��������������Ч���ٶ���������ŷš�Ŀǰ��õ���������ʪ��ʯ��ʯ��ʯ����������ʯ��ʯ�������е�SO2��Ӧ����ʯ��һ�ѳ�SO2��ij�о���ѧϰС����ʵ����������ͼ��ʾװ���Ʊ�ģ������(��Ҫ�ɷ�ΪSO2��CO2��N2��O2)�����ⶨ������SO2����������Լ��о�����ͨ��ת����������Ч�ʡ��ش��������⣺
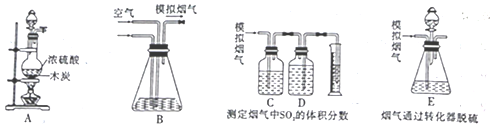
��.ģ���������Ʊ���
(1)װ�� A��ʢװŨ���������������_____________��д��װ��A�з�����Ӧ�Ļ�ѧ����ʽ��________��
��.�ⶨ������SO2�����������
(2)��֪װ��C��D��ʢ�е�ҩƷ�ֱ�������KMnO4��Һ������NaHCO3��Һ��д��װ��C����
�ã�_______________��װ��D�б���NaHCO3��Һ�е�����Ũ���ɴ�С�Ĺ�ϵΪ_____________��
(3)�ټ�ͬѧ��ΪӦ����װ��C��D֮������һ��ʢ��Ʒ����Һ��ϴ��ƿ��������_____________��
����ͬѧ����ģ������������a mL/min��t1���Ӻ��õ���Ͳ��Һ������VmL�����������ж�����������������Ϊ��֤ȷ��ȡ��Ͳ����Ӧע�⣺a.��װ����ȴ�����£�b._________��c.ƽ�ӡ�
��.ģ������ͨ��ת����������Ч���о���
(4)��ģ������ͨ��װ��E������ʢ��FeCl2��FeCl3�Ļ����Һ�������Դ�SO2�������ķ�Ӧ�Դﵽ�����Ŀ�ġ�д���������뷴Ӧ�����е����ӷ���ʽ��SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+��____________��
(5)��ģ����������amL/min������ͨ��ת����Eװ�ã�t2���Ӻ���Eװ���м����ữ��BaCl2��Һ���õ���ɫ����Һ�������ˡ�ϴ�ӡ�����������õ�m g���塣��ʵ���õ��������������Ϊ��״���µ���������ת����������Ч����________________��
���𰸡� Բ����ƿ C+2H2SO4(Ũ)![]() CO2��+2SO2��+2H2O ���������е�SO2���� c(Na+)��c(
CO2��+2SO2��+2H2O ���������е�SO2���� c(Na+)��c(![]() )��c(
)��c(![]() )��c(H+)��c(
)��c(H+)��c(![]() ) ����SO2�Ƿ���ȫ���� �����ƶ���Ͳʹ����ͲҺ������ƿD��Һ����ƽ 4Fe2++O2+4H+=2H2O+4Fe3+
) ����SO2�Ƿ���ȫ���� �����ƶ���Ͳʹ����ͲҺ������ƿD��Һ����ƽ 4Fe2++O2+4H+=2H2O+4Fe3+ ![]()
����������1��װ�� A��ʢװŨ�����������Բ����ƿ��װ��A��̿��Ũ���ᷴӦ���ɶ�����̼����������ˮ����ѧ����ʽΪC+2H2SO4(Ũ)![]() CO2��+2SO2��+2H2O��
CO2��+2SO2��+2H2O��
��Ϊ��Բ����ƿ �� C+2H2SO4(Ũ)![]() CO2��+2SO2��+2H2O
CO2��+2SO2��+2H2O
��2�����ⶨ������SO2�����ø��������Һ���ն�����������ˮ����������ʣ�������������NaHCO3��Һ�д���ˮ��͵��룬ˮ��̶ȴ��ڵ���̶ȣ���Һ�Լ��ԣ���ˮ�ⷽ��ʽΪ�� ![]() +H2O
+H2O ![]() H2CO3+
H2CO3+![]() ��NaHCO3��Һ�ʼ��ԣ�ˮ��̶ȴ��ڵ���̶ȣ�c��OH-����c��H+������������Ũ�ȹ�ϵΪ�� c(Na+)��c(
��NaHCO3��Һ�ʼ��ԣ�ˮ��̶ȴ��ڵ���̶ȣ�c��OH-����c��H+������������Ũ�ȹ�ϵΪ�� c(Na+)��c(![]() )��c(
)��c(![]() )��c(H+)��c(
)��c(H+)��c(![]() )����Ϊ�����������е�SO2���� ��c(Na+)��c(
)����Ϊ�����������е�SO2���� ��c(Na+)��c(![]() )��c(
)��c(![]() )��c(H+)��c(
)��c(H+)��c(![]() )
)
��3������Ҫ������������Ƿ���ȫ���գ�������C�� D ֮������һ��ʢ��Ʒ����Һ��ϴ��ƿ������������Ƿ���ȫ���բ���ȷ��ȡ��Ͳ����֮ǰ��ȴ�����¡��������ƶ���Ͳʹ����ͲҺ������ƿҺ����ƽ����Ϊ������SO2�Ƿ���ȫ���� �������ƶ���Ͳʹ����ͲҺ������ƿD��Һ����ƽ
��4����ģ������ͨ��װ��E������ʢ��FeCl2��FeCl3�Ļ����Һ�������Դ�SO2�������ķ�Ӧ�Դﵽ�����Ŀ�ġ�Fe3+��SO2����ΪSO42-�������ٰ�Fe2+����ΪFe3+��������Ӧ4Fe2++O2+4H+=2H2O+4Fe3+ ����Ϊ��4Fe2++O2+4H+=2H2O+4Fe3+
��5��t2�����������к�������������Ϊ��V��SO2��=at2��![]() %������������Ӧ��֪������֮�����Ĺ�ϵΪ��
%������������Ӧ��֪������֮�����Ĺ�ϵΪ��
 ����ת���Ķ���������������Ϊ��V��SO2���䣽
����ת���Ķ���������������Ϊ��V��SO2���䣽![]() ����������ת����=
����������ת����=![]() =
=![]() ����
���� ![]()

 ��У����ϵ�д�
��У����ϵ�д�


