题目内容
【题目】实验室里研究不同价态硫元素之间的转化
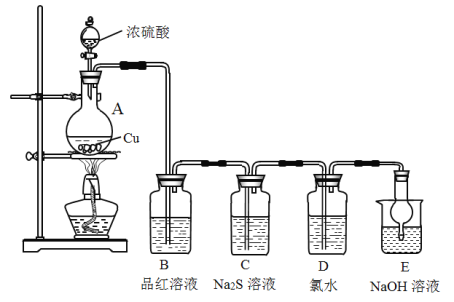
(1)A中发生反应的化学方程式为__________。
(2)B中的现象是__________。
(3)C中的现象是__________,Na2S在反应中做__________剂。
(4)D中氯水褪色,此反应中硫元素的化合价由_____转化为______;甲认为可以补充一个实验进一步证明硫元素的价态转化,实验方案和现象为:取D中褪色后的溶液于试管中________。
(5)E的作用是__________,离子方程式为__________。
(6)上述实验体现SO2的性质有__________。
【答案】Cu + 2 H2SO4(浓)![]() CuSO4 + SO2↑+ 2 H2O 品红溶液褪色 有淡黄色沉淀生成 还原 +4 +6 向其中加入BaCl2溶液(可以不加“盐酸酸化”),有白色沉淀生成 吸收SO2尾气,防止污染环境 SO2 + 2OH-= SO32- + H2O 漂白性、氧化性、还原性、酸性氧化物通性
CuSO4 + SO2↑+ 2 H2O 品红溶液褪色 有淡黄色沉淀生成 还原 +4 +6 向其中加入BaCl2溶液(可以不加“盐酸酸化”),有白色沉淀生成 吸收SO2尾气,防止污染环境 SO2 + 2OH-= SO32- + H2O 漂白性、氧化性、还原性、酸性氧化物通性
【解析】
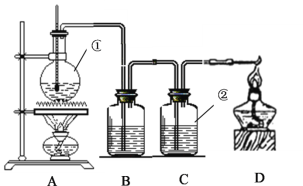
该实验的目的是研究不同价态硫元素之间的转化;A为SO2的发生装置,B为检验SO2的装置,C中Na2S和SO2发生氧化还原反应生S沉淀,D中SO2和Cl2以及水反应生成H2SO4,E是吸收多余SO2的装置。
(1)A中Cu和浓硫酸反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)B为检验SO2的装置,现象是品红溶液褪色;
(3)C中,Na2S和SO2发生反应:2Na2S+SO2+2H2O=3S↓+4NaOH,故可观察到有淡黄色沉淀生成,该反应中,Na2S中S的化合价由-2价升为0价,故Na2S作还原剂;
(4)D中,Cl2和SO2发生反应:Cl2+SO2+2H2O=2HCl+H2SO4,S由+4价变为+6价;要想证明硫元素的价态转化,只需要证明产物中有SO42-即可,由于产物中已经有HCl,故只需要取D中褪色后的溶液于试管中,加入BaCl2溶液即可,对应的现象是有白色沉淀生成;
(5)E的作用是吸收SO2尾气,防止污染环境;离子方程式为:SO2+2OH-= SO32-+H2O
(6)B中现象体现SO2的漂白性,C中现象体现SO2的氧化性,D中现象体现SO2的还原性,E中现象体现酸性氧化物的通性。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol
C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
2C(s)+O2(g)=2CO(g)△H3=-221kJ/mol
若某反应的平衡常数表达式为:K=[c(N2) ·c2(CO2)]/[c2(NO) ·c2(CO)],则此反应的热化学方程式为____________________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
c(N2O5)/<mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2min时体系压强为p1,则p1∶p0=__________。2~5min内用NO2表示的该反应的平均反应速率为__________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__________。(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)![]() NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200℃、400℃、600℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
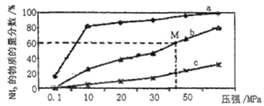
①曲线a对应的温度是__________。
②M点对应的H2的转化率是__________。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:______________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8。)