��Ŀ����
����Ŀ��Cu2+����NH3��H2O��OH����Cl�����γ���λ��Ϊ4������
��1����CuSO4��Һ�м������NaOH��Һ������Na2[Cu��OH��4]��
�ٻ���������[Cu��OH��4]2+�е���λ��__��
��Na2[Cu��OH��4]�г�����λ���⣬�����ڵĻ�ѧ��������__������ţ���
A�����Ӽ� B�������� C�����Թ��ۼ� D���Ǽ��Թ��ۼ�
��2������ͭ�����백ˮ��������ⶼ���ܷ�Ӧ�������백ˮ��������Ļ����Һ�������·�Ӧ��Cu+H2O2+4NH3�T[Cu��OH��4]2++2OH������ԭ����_________________��
��3��Cu2+�������Ҷ�����H2N��CH2CH2��NH2���γ������ӣ���ͼ����

��H��O��N����Ԫ�صĵ縺�ԴӴ�С��˳��____��
���Ҷ���������Nԭ�ӳɼ�ʱ��ȡ���ӻ�������__��
���Ҷ����е����Cl��CH2CH2��Cl����Ҫԭ����__��
���𰸡� AC ��������Ϊ����������������Cu2+�γ���λ����������ٽ�ʹ��Ӧ���� O��N��H sp3 �Ҷ������Ӽ����γ����
AC ��������Ϊ����������������Cu2+�γ���λ����������ٽ�ʹ��Ӧ���� O��N��H sp3 �Ҷ������Ӽ����γ����
��������
��1����Cu2+���пչ����OH-���й¶Ե��ӣ����γ���λ����
��Na2[Cu��OH��4]�г�����λ���⣬���������Ӽ��ͼ��Թ��ۼ���
��2���������������Cu����Cu2+�������백�����γ���λ����
��3���ٸ��ݵ縺�������ڱ��еݱ���ɷ�����
���Ҷ���������Nԭ���γ�4��������
���Ҷ������Ӽ����γ������
(1)��Cu2+���пչ����OH���й¶Ե���,���γ���λ����������[Cu(OH)4]2+��1��Cu2+��4��OH�γ���λ�����ɱ�ʾΪ ���ʴ�Ϊ��
���ʴ�Ϊ��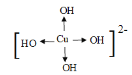 ��
��
��Na2[Cu(OH)4]Ϊ���ӻ�����������Ӽ�������OHΪ���Թ��ۼ����ʴ�Ϊ��AC��
(2)�������������Cu����Cu2+�������백�����γ���λ����
�ʴ�Ϊ����������Ϊ����������������Cu2+�γ���λ����������ٽ�ʹ��Ӧ���У�
(3)��ͬ����Ԫ�ش�����Ԫ�صĵ縺������ǿ����O>N��H�ĵ縺������������O>N>H���ʴ�Ϊ��O>N>H��
���Ҷ���������Nԭ���γ�4��������Ϊsp3�ӻ����ʴ�Ϊ��sp3��
��NԪ�ص縺�Խ�ǿ�����γ�������е�ϸߣ��ʴ�Ϊ���Ҷ������Ӽ����γ������

����Ŀ��ij����������������������������е�ij����(������ˮ�ĵ���)��
������ | K����Ba2����Ag����Mg2����NH |
������ | Cl����SO |
Ϊ���жϸû�������ɣ������ν�������ʵ�飬����ʵ�����ش��������⣺
��1��ȡ�ù��������ˮ�������ȫ�ܽ�õ���ɫ��Һ����pH��ֽ�����Һ��pHΪ12��ʵ����δ�ᵽ�̼�����ζ������������п϶������ڵ�������________��
��2����(1)������Һ�еμ����ᣬ�г������ɣ�ͬʱ����ɫ��ζ�����ݳ�����϶����ڵ�������___�������ų���������________��
��3��ȡ(2)ʵ�����ϲ���Һ���μ�AgNO3��Һ���а�ɫ�������ɡ�˼������û�������д����飿������д������������������ļ��鷽��(Ҫ��д������IJ��衢���������)�� ________�������Ϊû���д���������ӣ��˿ղ��