题目内容
【题目】高氯酸三碳酰肼合镍{[Ni(CHZ)3](C104)2}是一种新型的起爆药。
(1)Ni2+核外电子排布式为___。
(2)ClO4-空间构型是___;与ClO4-互为等电子体的一种分子为___(填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为___;C、N、O三种元素的电负性由大到小的顺序为___。
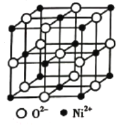
(4)高氯酸三碳酰肼合镍可由NiO、髙氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为___。
【答案】[Ar]3d8或1s22s22p63s23p63d8 正四面体 CCl4(或SiF4等) sp2 O>N>C 4
【解析】
(1)基态镍原子有28个电子,其原子核外有2个未成对电子,镍原子失去最外层两个电子生成二价镍离子,根据构造原理书写二价镍离子核外电子排布式;
(2)计算Cl原子价层电子对数、孤电子对,进而确定ClO4-的空间构型;原子总数相同、价电子总数相同的微粒互为等电子体;
(3)CO(N2H3)2中C原子与O原子之间形成双键,与N原子之间形成C-N单键,没有孤对电子,据此确定杂化轨道数目,进而确定杂化方式;同周期自左而右电负性增大,据此规律进行分析;
(4) 利用均摊法进行晶胞中粒子数目的分析。
(1)Ni元素原子核外有28个电子,原子核外电子排布为1s22s22p63s23p63d84s2,3d能级有2个未成对的电子,Ni失去4s能级2个电子形成Ni2+,Ni2+离子核外电子排布式为: [Ar]3d8或1s22s22p63s23p63d8 ;
答案是: [Ar]3d8或1s22s22p63s23p63d8 ;
(2) ClO4-中氯原子价层电子对数为4+(7+1-2×4)/2=4、没有孤电子对,故其空间构型是正四面体;原子总数相同、价电子总数相同的微粒互为等电子体,与ClO4-互为等电子体的一种分子为CCl4(或SiF4等);
故答案是:正四面体;CCl4(或SiF4等);
(3)CO(N2H3)2中C原子与O原子之间形成双键,与N原子之间形成C-N单键,没有孤对电子,杂化轨道数目为3,C原子采取sp2 杂化;同周期自左而右电负性增大,故电负性: O>N>C;
故答案是:sp2;O>N>C;
(4) Ni2+离子位于晶胞顶点及面心,晶胞中Ni2+数目x=8×1/8+6×1/2=4;
故答案是:4。