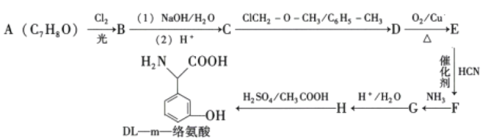
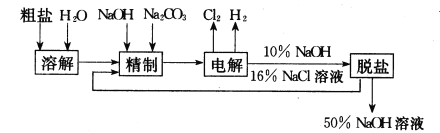
题目内容
【题目】目前,人们对环境保护、新能源开发非常重视。
(1)已知:①CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)ΔH1=-860.0kJmol1
N2(g)+CO2(g)+2H2O(g)ΔH1=-860.0kJmol1
②2NO2(g)![]() N2O4(g)ΔH2=-66.9kJmol1
N2O4(g)ΔH2=-66.9kJmol1
写出CH4催化还原N2O4(g)生成N2、H2O(g)和CO2的热化学方程式_____________。
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH,在t1℃时,反应进行到不同时间测得各物质的物质的量浓度如下:
N2(g)+CO2(g) ΔH,在t1℃时,反应进行到不同时间测得各物质的物质的量浓度如下:
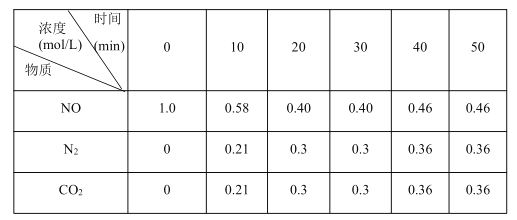
①根据表中数据分析,t1℃时,该反应在0~20min的平均反应速率v(NO)=_____________,该反应的平衡常数K=_____________。
②30min时,只改变某一条件,根据上表中的数据判断改变的条件可能是_____________(填字母代号)。
A.适当缩小容器的体积B.加入合适的催化剂
C.加入一定量的活性炭D.通入一定量的NO
③若30min后升高温度至t2℃,达到平衡时,容器中NO、N2、CO的浓度之比为5∶3∶3,则达到新平衡时NO的转化率_____________(填“升高”或“降低”);ΔH_____________0(填“>”或“<”)。
(3)①已知在一定温度下,反应2NH3(g)+CO2(g)![]() H2NCOONH4(s)ΔH=159.5kJmol1,在2L恒容密闭容器中充入2molNH3和1molCO2,到达平衡时放出127.6kJ的热量,此时,c(NH3)为_____________。
H2NCOONH4(s)ΔH=159.5kJmol1,在2L恒容密闭容器中充入2molNH3和1molCO2,到达平衡时放出127.6kJ的热量,此时,c(NH3)为_____________。
②有一种可充电电池NaAl/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池负极电极反应式为Nae=Na+,则正极反应式为____________。
【答案】CH4(g)+N2O4(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-793.1kJmol-1 0.03mol·L1·min1 0.56 AD 降低 < 0.2mol·L-1 2Na++FeS+2e-=Na2S+Fe
N2(g)+CO2(g)+2H2O(g) △H=-793.1kJmol-1 0.03mol·L1·min1 0.56 AD 降低 < 0.2mol·L-1 2Na++FeS+2e-=Na2S+Fe
【解析】
(1)CH4还原N2O4的化学方程式为CH4+N2O4=N2+2H2O+CO2,根据盖斯定律①-②得到CH4催化还原N2O4(g)生成N2、H2O(g)和CO2的热化学方程式;
(2)①分析图表数据,根据v=△c/△t计算得到反应速率,根据K= c(N2)×c(CO2)/ c2(NO)计算平衡常数K;
②该反应是气体体积不变的反应,依据图表数据分析,平衡状态各物质浓度均增大,平衡常数不变说明改变的条件可能是减小容器体积或加入一定量一氧化氮;
③若30min后升高温度至t2℃,达到平衡时,容器中NO、N2、CO2的浓度之比从为5:3:3,氮气和二氧化碳浓度之比始终为1:1,所以5:3>4:3,说明平衡向逆反应方向移动;
(3)①由反应2NH3(g)+CO2(g)H2NCOONH4(s) △H=-159.5kJ/mol可知:2molNH3反应放出159.5kJ热量,则有1.6molNH3反应放出127.6kJ热量;
②原电池的电极材料Na-Al/FeS,负极材料为Na,电极反应式为Na-e-=Na+,电池工作时Na+的物质的量保持不变,则正极FeS得到电子结合Na+生成Na2S和Fe。
(1)由盖斯定律①②得到CH4(g)+N2O4(g)N2(g)+CO2(g)+2H2O(g)的△H=(860.0kJ/mol)(66.9kJ/mol)=793.1kJ/mol,所以热化学方程式为:CH4(g)+N2O4(g)N2(g)+CO2(g)+2H2O(g) △H=793.1kJ/mol,故答案为:CH4(g)+N2O4(g)N2(g)+CO2(g)+2H2O(g) △H=793.1
kJ/mol;
(2)①020min内,NO的平均反应速率v(NO)=(1.00.4)mol·L-1/20min=0.03molL1min1,C(s)+2NO(g)N2(g)+CO2(g)的平衡浓度
c(N2)=c(CO2)=0.3mol/L;c(NO)=0.4mol/L,反应的平衡常数:K= c(N2)×c(CO2)/ c2(NO)=0.3×0.3/0.42=0.56,故答案为:0.03mol·L1·min1;0.56;
②A. 适当缩小容器的体积,反应前后体积不变,平衡状态物质浓度同比增大,A正确;
B. 加入合适的催化剂,催化剂只改变化学反应速率,不改变化学平衡,B错误;
C. 加入一定量的活性炭,碳是固体对平衡无影响,平衡不动,C错误;
D. 通入一定量的NO,达到新平衡状态时,各物质平衡浓度均增大,D正确;故答案为:AD;
③若30min后升高温度至t2℃,达到平衡时,容器中NO、N2、CO2的浓度之比从为5:3:3,氮气和二氧化碳浓度之比始终为1:1,因5:3>4:3,说明平衡向逆反应方向移动,达到新平衡时NO的转化率降低,说明逆反应是吸热反应,则正反应是放热反应,故答案为:降低;<;
(3)①反应2NH3(g)+CO2(g)![]() H2NCOONH4(s) ΔH=159.5kJ·mol-1可知:2molNH3反应放出159.5kJ热量,则有1.6molNH3反应,剩余NH3是(2mol1.6mol)=0.4mol,浓度为0.2mol/L,故答案为:0.2mol/L;
H2NCOONH4(s) ΔH=159.5kJ·mol-1可知:2molNH3反应放出159.5kJ热量,则有1.6molNH3反应,剩余NH3是(2mol1.6mol)=0.4mol,浓度为0.2mol/L,故答案为:0.2mol/L;
②原电池的电极材料NaAl/FeS,负极材料为Na,电极反应式为Nae=Na+,电池工作时Na+的物质的量保持不变,则正极FeS得到电子结合Na+生成Na2S和Fe,所以电极反应式为:2Na++FeS+2e-=Na2S+Fe,故答案为:2Na++FeS+2e-=Na2S+Fe。

 名校课堂系列答案
名校课堂系列答案【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,作为信息产业和机电工业的重要基础功能材料,磁性材料广泛应用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:
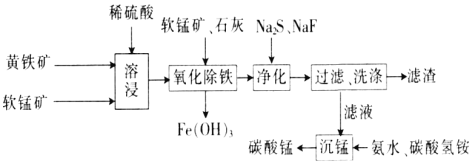
已知:几种金属离子沉淀的pH如下表。
Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10.4 |
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有________。
A.搅拌 B.适当升高温度
C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的离子为Fe3+、Mn2+、SO42-,请写出主要反应的离子方程式:___________;浸取后的溶液中含有少量Fe2+、Cu2+、Ca2+,则在加入石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿目的是______________________,加入石灰调节溶液pH的范围为____________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是________(填化学式)和CaF2。若测得滤液中c(F-)为0.01mol·L-1,则滤液中残留c(Ca2+)为________mol·L-1[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是______________________________________。
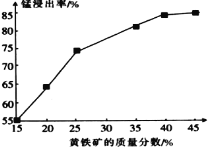
(5)如图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在________%左右。