��Ŀ����
����Ŀ��DL��m���簱����һ��Ӫ����������������������������һ�ֺϳ�DL��mһ�簱���·�����£�
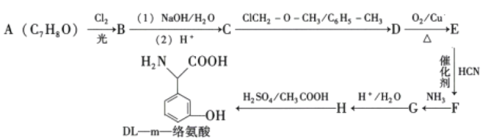
��֪����
��
��
�ش��������⣺
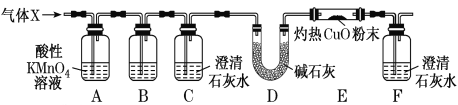
��1��A�Ļ�ѧ����Ϊ ________��F�к��������ŵ�������________��
��2��E��F�ķ�Ӧ����Ϊ________��
��3��д��D��E�Ļ�ѧ����ʽ________��
��4��������M��һ�����������ᣬ��H��ͬ���칹�塣��������������M��ͬ���칹����________�֡�
i.����������������λ�ϵ�ȡ��������FeCl3��Һ���ܷ�����ɫ��Ӧ��
ii.1molM�����������Ʒ�Ӧ����1.5molH2��
���з����д�����������̼ԭ�ӣ�������Ũ��������������·�����ȥ��Ӧ�����������ԣ����칹��Ľṹ��ʽΪ________��________����֪�������д�������̼ԭ�ӵķ��ӽ����Է��ӣ����Է��Ӿ��������ԣ���
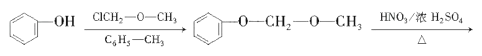
��5��![]() �Ǻϳ�ҩ������Ϣ�۵��м��塣����ɱ��Ӻ�ClCH2��O��CH3�Ʊ�
�Ǻϳ�ҩ������Ϣ�۵��м��塣����ɱ��Ӻ�ClCH2��O��CH3�Ʊ�![]() �ĺϳ�·��________�����Լ���ѡ����
�ĺϳ�·��________�����Լ���ѡ����
���𰸡�������ӻ�3�������� �ǻ����Ѽ� �ӳɷ�Ӧ 2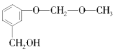 +O2
+O2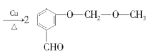 +2H2O 7
+2H2O 7 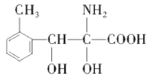

��������
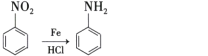
AΪ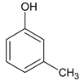 ���ڹ��������£�����������ȡ����Ӧ����B��BΪ
���ڹ��������£�����������ȡ����Ӧ����B��BΪ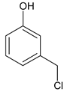 ��B��NaOHˮ��Һ�з���ˮ�⣬���ữ������C��CΪ
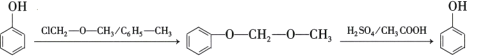
��B��NaOHˮ��Һ�з���ˮ�⣬���ữ������C��CΪ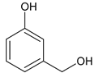 ��������Ϣ��C��ClCH2��O��CH3����ȡ����Ӧ����D��DΪ
��������Ϣ��C��ClCH2��O��CH3����ȡ����Ӧ����D��DΪ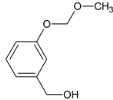 ��D��ͭ�����´���������E��EΪ
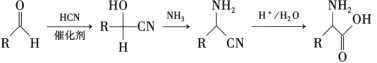
��D��ͭ�����´���������E��EΪ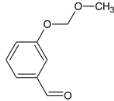 ��E��HCN�����ӳɷ�Ӧ����F��FΪ
��E��HCN�����ӳɷ�Ӧ����F��FΪ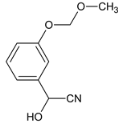 ��F�백����ȡ����Ӧ����G
��F�백����ȡ����Ӧ����G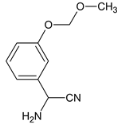 ��Gˮ�������H
��Gˮ�������H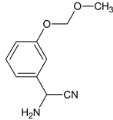 ��H��������������Ƶò�Ʒ��
��H��������������Ƶò�Ʒ��
��1��AΪ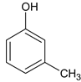 ����ѧ����Ϊ������ӻ�3�������ӣ�FΪ
����ѧ����Ϊ������ӻ�3�������ӣ�FΪ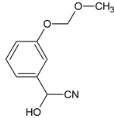 �����������ŵ��������ǻ����Ѽ����ʴ�Ϊ��������ӻ�3�������ӣ��ǻ����Ѽ���
�����������ŵ��������ǻ����Ѽ����ʴ�Ϊ��������ӻ�3�������ӣ��ǻ����Ѽ���
��2��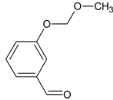 ��HCN�����ӳɷ�Ӧ����F��FΪ
��HCN�����ӳɷ�Ӧ����F��FΪ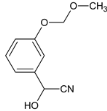 ��E��F�ķ�Ӧ����Ϊ�ӳɷ�Ӧ���ʴ�Ϊ���ӳɷ�Ӧ��
��E��F�ķ�Ӧ����Ϊ�ӳɷ�Ӧ���ʴ�Ϊ���ӳɷ�Ӧ��
��3��D��ͭ�����´���������E��D��E�Ļ�ѧ����ʽ2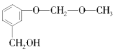 +O2
+O2 +2H2O���ʴ�Ϊ��2
+2H2O���ʴ�Ϊ��2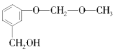 +O2
+O2 +2H2O��
+2H2O��
��4��������M��һ�����������ᣬ��H��ͬ���칹�塣i.����������������λ�ϵ�ȡ��������FeCl3��Һ���ܷ�����ɫ��Ӧ��û�з��ǻ���ii.1molM�����������Ʒ�Ӧ����1.5molH2�����Ȼ�����������ǻ�������������M��ͬ���칹����7�֣��ֱ��ǣ�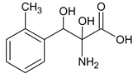 ��
��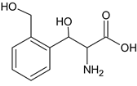 ��
��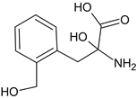 ��
��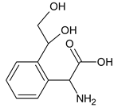 ��
��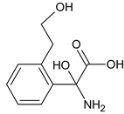 ��
��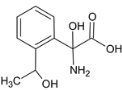 ��
��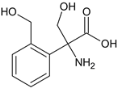 �����з����д�����������̼ԭ�ӣ�������Ũ��������������·�����ȥ��Ӧ�����������ԣ����칹��Ľṹ��ʽΪ
�����з����д�����������̼ԭ�ӣ�������Ũ��������������·�����ȥ��Ӧ�����������ԣ����칹��Ľṹ��ʽΪ ��
�� ��
��
�ʴ�Ϊ��7�� ��
�� ��
��
��5��![]() �Ǻϳ�ҩ������Ϣ�۵��м��壬�ɱ��Ӻ�ClCH2��O��CH3�Ʊ�
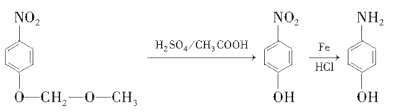
�Ǻϳ�ҩ������Ϣ�۵��м��壬�ɱ��Ӻ�ClCH2��O��CH3�Ʊ�![]() �������백�������У�Ҫ��ŨHNO3����������Ӧ�����ǻ��ױ�����������б������ϳ�·�����£�
�������백�������У�Ҫ��ŨHNO3����������Ӧ�����ǻ��ױ�����������б������ϳ�·�����£�
 ��
��
�ʴ�Ϊ��
 ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�