题目内容
【题目】化学在可持续发展和能源的综合利用作出了巨大贡献。煤、石油、天然气这些化石能源如何更好的综合利用,相关技术日益成熟,请回答下列问题:
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)![]() CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为___;
②下列能增大碳的转化率的措施是___;(填写相应字母)
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
根据表中数据:
①计算反应CO2(g)+H2(g)![]() CO(g)+H2O(g) 温度在973 K时的K=__;(结果保留小数点后2位)
CO(g)+H2O(g) 温度在973 K时的K=__;(结果保留小数点后2位)
②反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是___(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是___(填“吸热”或“放热”)反应。
③已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应__(填“已经”或“没有”)达到平衡,此时刻v正___v逆(填“>”、“<”或“=”)。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应__(填“已经”或“没有”)达到平衡,此时刻v正___v逆(填“>”、“<”或“=”)。
【答案】K=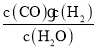 BC 0.62 吸热 没有 >
BC 0.62 吸热 没有 >
【解析】
(1)①平衡常数表达式是生成物浓度幂之积比反应物浓度幂之积,固体和纯液体不代入表达式;
②在不改变碳的量情况下,改变条件使平衡正向移动;
(2)①温度为973K时,Fe(s)+CO2(g)![]() FeO(s)+CO(g)①、Fe(s)+H2O(g)
FeO(s)+CO(g)①、Fe(s)+H2O(g)![]() FeO(s)+H2(g)②,将方程式①-②得反应CO2(g)+H2(g)
FeO(s)+H2(g)②,将方程式①-②得反应CO2(g)+H2(g)![]() CO(g)+H2O(g),则CO2(g)+H2(g)
CO(g)+H2O(g),则CO2(g)+H2(g) ![]() CO(g)+H2O(g)K=
CO(g)+H2O(g)K=![]() ;
;
②结合反应CO2(g)+H2(g)![]() CO(g)+H2O(g)在1173K时的平衡常数,判断平衡移动的方向,确定△H;
CO(g)+H2O(g)在1173K时的平衡常数,判断平衡移动的方向,确定△H;
③计算此时的浓度商和平衡常数比较判断反应进行的方向。
(1)①根据C(s)+H2O(g)![]() CO(g)+H2(g)可知平衡常数表达式为:K=
CO(g)+H2(g)可知平衡常数表达式为:K=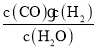 ;
;
②A.加入C(s),平衡不移动,故A错误;
B.加入H2O(g),平衡正向移动,碳的转化率变大,故B正确;
C.正反应是吸热反应,升高温度,平衡正向移动,碳的转化率变大,故C正确;
D.增大压强,平衡逆向移动,碳的转化率变小,故D错误;
故选BC;
(2)①温度为973K时,Fe(s)+CO2(g) ![]() FeO(s)+CO(g)①、Fe(s)+H2O(g)
FeO(s)+CO(g)①、Fe(s)+H2O(g) ![]() FeO(s)+H2(g)②,将方程式①-②得反应CO2(g)+H2(g)
FeO(s)+H2(g)②,将方程式①-②得反应CO2(g)+H2(g) ![]() CO(g)+H2O(g),则CO2(g)+H2(g)
CO(g)+H2O(g),则CO2(g)+H2(g) ![]() CO(g)+H2O(g)的K=
CO(g)+H2O(g)的K=![]() =
=![]() =0.62;
=0.62;
②反应CO2(g)+H2(g)![]() CO(g)+H2O(g)在1173K时的平衡常数K=
CO(g)+H2O(g)在1173K时的平衡常数K=![]() =
=![]() =1.29>0.62,说明温度升高,平衡常数增大,反应正向移动,△H>0,即正反应为吸热反应;
=1.29>0.62,说明温度升高,平衡常数增大,反应正向移动,△H>0,即正反应为吸热反应;
③已知在T℃时,CO(g)+H2O(g) ![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1molL-1,c始(H2O)=1molL-1,某时刻经测定CO的转化率为10%,反应的CO浓度为0.1mol/L,则
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1molL-1,c始(H2O)=1molL-1,某时刻经测定CO的转化率为10%,反应的CO浓度为0.1mol/L,则
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 1 1 0 0
变化浓度(mol/L) 0.1 0.1 0.1 0.1
某时刻浓度(mol/L) 0.9 0.9 0.1 0.1
则该反应的浓度商Qc=![]() =0.012<K=0.32,反应未达到平衡状态,反应正向进行,v正>v逆。
=0.012<K=0.32,反应未达到平衡状态,反应正向进行,v正>v逆。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
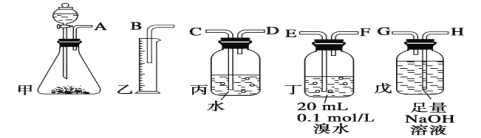
全优冲刺100分系列答案【题目】某实验小组用0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸进行中和热的测定,测定稀硫酸和稀氢氧化钠溶液反应的中和热的实验装置如图所示:

(1)仪器A的名称为___。
(2)装置中碎泡沫塑料的作用是___。
(3)写出表示该反应中和热的热化学方程式(中和热为57.3kJ·mol-1):___。
(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
1 | H2SO4 | NaOH | 平均值 | ||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差平均值为___℃。
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·(g·℃)-1。则中和热△H=-53.5kJ/mol。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度