题目内容
13.化学反应A2+B2═2AB的能量变化如图所示,则下列说法正确的是( )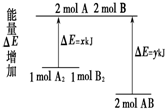
| A. | 因为该反应为放热反应,故不必加热反应就可发生 | |
| B. | 断裂1 mol A-A 键和1 mol B-B 键放出x kJ能量 | |
| C. | 断裂2 mol A-B 键需要吸收y kJ的能量 | |
| D. | 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
分析 A、放热反应有的也需要加热;
B、根据旧键的断裂吸收能量,新键的生成释放能量;
C、根据旧键的断裂吸收能量;
D、根据图象可判断反应物与生成物的总能量.
解答 解:A、反应吸放热与反应条件无必然关系,放热反应有的也需要加热,如煤炭的燃烧是放热的,需先加热才能进行,故A错误;
B、因旧键的断裂吸收能量,而不是释放能量,故B错误;
C、因旧键的断裂吸收能量,由图可知断裂2molA-B键需要吸收ykJ能量,故C正确;
D、由图可知,1molA2和1molB2的总能量高于2molAB的总能量,故D错误;
故选C.
点评 本题考查学生有关化学反应中的能量变化知识,可以根据所学知识来进行,难度不大.

练习册系列答案
相关题目
4.下列事实中能说明醋酸是弱电解质的是( )
| A. | 醋酸溶液作导电试验,灯光较暗 | |
| B. | 醋酸(CH3COOH)是共价化合物 | |
| C. | 醋酸不与氯化钠反应 | |
| D. | 常温下1mol.L-1醋酸溶液的c(H+)约为0.004mol•L-1 |
1.下列化学性质叙述或有关化学反应表达正确的是( )
| A. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| B. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 除去乙烷中混有的乙烯的方法是通氢气在一定条件下反应,使乙烯转化为乙烷 |
8.对照元素周期表,下列叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 过渡元素中可寻找制备催化剂及耐高温、耐腐蚀材料的元素 | |
| C. | 在非金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 周期表中第Ⅷ族元素种类最多 |
18.下列物质在空气中变质,与二氧化碳无关的是( )
| A. | 漂粉精 | B. | 生石灰 | C. | 过氧化钠 | D. | 亚硫酸钠 |
5.下列说法不正确的是( )
| A. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” | |
| B. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 | |
| C. | pH计也可用于酸碱中和滴定终点的判断 | |
| D. | 海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t.由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素” |
2.电解法是处理工业废水的一种重要方法.如酸性含(Cr2O72-)废水就可以采用电解法进行无害化处理.电解时采用Fe作阳极,惰性电极作阴极.已知:①氧化性:Cr2O72->Fe3+;②Cr2O72-被还原生成Cr3+;③Ksp[Cr (OH)3]=6.3×10-31.下列说法正确的是( )
| A. | 阳极材料也可以是Cu | |
| B. | 阴极每产生3molH2,则有1mol Cr2O72-被还原 | |
| C. | 一段时间后溶液中发生反应Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 电解最后阶段需要加碱,使溶液中的阳离子转化为沉淀 |
3.如图是部分短周期主族元素原子半径与原子序数的关系图.字母代表元素,下列有关分析正确的是( )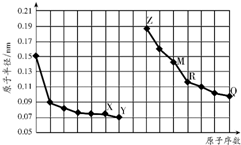

| A. | R在周期表的第14列 | |
| B. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
 (1)某温度时,2L的密闭容器中X、Y、Z=种气体物质的物质的量随时间的变化如图 所示.
(1)某温度时,2L的密闭容器中X、Y、Z=种气体物质的物质的量随时间的变化如图 所示.