题目内容
【题目】H2C2O4(草酸)是一种无色晶体,易溶于水,熔点为182℃,150~160℃升华,189.5℃分解。25℃时,Ka1=6×10-2,Ka2=6.4×10-5,Ksp(CaC2O4)=4.0×10-9。某校甲、乙、丙3个学习小组设计实验探究草酸的化学性质。
(1)草酸中所含官能团的名称为__________;
反应Ca2+(aq)+H2C2O4(aq)![]() CaC2O4(s)+2H+(aq),25℃时的平衡常数K=__________。
CaC2O4(s)+2H+(aq),25℃时的平衡常数K=__________。
(2)甲组同学在Na2CO3溶液中加入少量草酸溶液产生大量气体,他们查得H2CO3的Ka1=4.47×10-7,Ka2=4.68×10-11,则发生反应的离子方程式为______________。
(3)乙组同学在酸性KMnO4溶液中逐滴加入草酸溶液,溶液紫色逐渐褪去,说明草酸具有_____性,反应中氧化产物与还原产物的物质的量之比为_________。
(4)丙组同学设计下列装置分解H2C2O4并设计实验装置检验产物中的CO2和CO。
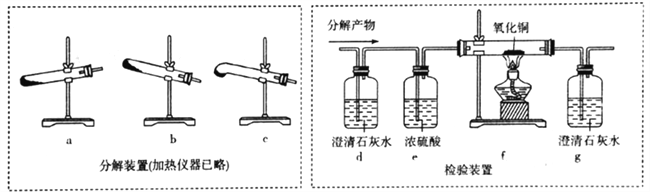 ①分解H2C2O4装置中最好的是__________(填字母)。
①分解H2C2O4装置中最好的是__________(填字母)。
②d中澄清石灰水变浑浊,能否说明有CO2生成? ___(填“能“或“不能”,下同),理由是________;仅依据装置g中澄清石灰水变浑浊,能否说明有CO生成?_________,理由是_____________。
【答案】 羧基 9.6×102 H2C2O4 +CO32-=CO2 ↑+C2O42- + H2O 还原 5:1 c 不能 H2C2O4 随产物进人装置d 会产生CaC2O4 沉淀 不能 无法证明从d逸出的气体中是否混有CO2
【解析】试题分析:(1)草酸的结构简式的HOOCCOOH;平衡常数K=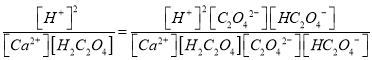 ;(2)H2C2O4的Ka2大于H2CO3的Ka1,所以Na2CO3溶液中加入少量草酸溶液生成Na2C2O4和CO2;(3)KMnO4溶液具有强氧化性;高锰酸钾溶液与草酸反应的化学方程式是2KMnO4+3H2SO4+5H2C2O4===K2SO4+2MnSO4+10CO2↑+8H2O;(4)①根据H2C2O4的熔点低于H2C2O4分解的温度分析;②根据草酸易升华分析;没有验证从d逸出的气体中是否混有CO2;
;(2)H2C2O4的Ka2大于H2CO3的Ka1,所以Na2CO3溶液中加入少量草酸溶液生成Na2C2O4和CO2;(3)KMnO4溶液具有强氧化性;高锰酸钾溶液与草酸反应的化学方程式是2KMnO4+3H2SO4+5H2C2O4===K2SO4+2MnSO4+10CO2↑+8H2O;(4)①根据H2C2O4的熔点低于H2C2O4分解的温度分析;②根据草酸易升华分析;没有验证从d逸出的气体中是否混有CO2;
解析:(1)草酸的结构简式的HOOCCOOH,含有的官能团是羧基;平衡常数K=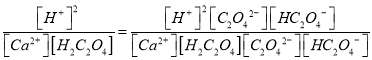 =
=![]() 9.6×102;(2)(2)H2C2O4的Ka2大于H2CO3的Ka1,所以Na2CO3溶液中加入少量草酸溶液生成Na2C2O4和CO2,反应的离子方程式是H2C2O4+CO32-=CO2↑+C2O42-+H2O;(3)KMnO4溶液具有强氧化性,高锰酸钾溶液褪色说明高锰酸钾被还原,所以草酸具有还原性;高锰酸钾溶液与草酸反应的化学方程式是2KMnO4+3H2SO4+5H2C2O4===K2SO4+2MnSO4+10CO2↑+8H2O,CO2是氧化产物、MnSO4是还原产物,氧化产物与还原产物的物质的量之比为5:1;(4)①根据H2C2O4的熔点低于H2C2O4分解的温度,所以分解H2C2O4装置中最好的是C;②根据草酸易升华,H2C2O4随产物进人装置d会产生CaC2O4沉淀,所以d中澄清石灰水变浑浊,不能说明有CO2生成;没有验证从d逸出的气体中是否混有CO2,所以仅依据装置g中澄清石灰水变浑浊,不能说明有CO生成;
9.6×102;(2)(2)H2C2O4的Ka2大于H2CO3的Ka1,所以Na2CO3溶液中加入少量草酸溶液生成Na2C2O4和CO2,反应的离子方程式是H2C2O4+CO32-=CO2↑+C2O42-+H2O;(3)KMnO4溶液具有强氧化性,高锰酸钾溶液褪色说明高锰酸钾被还原,所以草酸具有还原性;高锰酸钾溶液与草酸反应的化学方程式是2KMnO4+3H2SO4+5H2C2O4===K2SO4+2MnSO4+10CO2↑+8H2O,CO2是氧化产物、MnSO4是还原产物,氧化产物与还原产物的物质的量之比为5:1;(4)①根据H2C2O4的熔点低于H2C2O4分解的温度,所以分解H2C2O4装置中最好的是C;②根据草酸易升华,H2C2O4随产物进人装置d会产生CaC2O4沉淀,所以d中澄清石灰水变浑浊,不能说明有CO2生成;没有验证从d逸出的气体中是否混有CO2,所以仅依据装置g中澄清石灰水变浑浊,不能说明有CO生成;