��Ŀ����
����Ŀ����ȸʯ��Ҫ�ɷ���Cu2(OH)2CO3,��������FeCO3��Si�Ļ����ʵ�����Կ�ȸʯΪԭ���Ʊ�����ͭ����IJ�������:
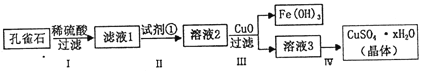
��1������I���漰����Ҫ��Ӧ�����ӷ���ʽ��ʾΪ___________.
��2�����������Լ�����_______(�����).
a.KMnO4 b.H2O2 c.Fe�� d.KSCN
��3������������CuO ��Ŀ����_________
��4���������������ͭ���壬��Ҫ����_____________��ȴ�ᾧ�����˵Ȳ���.
��5���ⶨ����ͭ����(CuSO4��xH2O)�нᾧˮ��xֵ:��ȡ2.41g����ͭ���壬��____(��ʵ����������)�м������������ٸı�ʱ��������ĩ������Ϊ1.6g.������x=______(��������ȷ��0.1)
���𰸡� Cu2(OH)2CO3+4H+=2Cu2++CO2��+3H2O b ������ʹ��ҺpH����(�������ҺpH)������Fe3+(ˮ��)�γɳ�����ȥ ����Ũ��(������Ũ��) ���� 4.5
����������1������I��Ӧ�漰����Ҫ��Ӧ�ǿ�ȸʯ��ϡ���ᷴӦ��������ͭ��������̼��ˮ�������ӷ���ʽ��ʾΪ��Cu2(OH)2CO3+4H+=2Cu2++CO2��+3H2O����2��ʵ��������Ƚ���ʯ�ܽ⣬���Լ���ϡ�����ܽ��ʽ̼��ͭ��̼����������Fe2+����ΪFe3+�������������ʣ�ѡ�ù������⣬��ѡb����3���������Һ2�м���CuO��������ʹ��ҺpH����(�������ҺpH)������Fe3+(ˮ��)�γɳ�����ȥ����4���������������ͭ���壬��Ҫ��������Ũ��(������Ũ��)����ȴ�ᾧ�����˵Ȳ�������5���������м�������ͭ�������������ٸı�ʱ�����÷�ĩΪCuSO4�����������ʵ�����n(CuSO4)= ![]() =
=![]() =0.01mol�������ٵ�ˮ������m(H2O)=2.41g-1.6g=0.81g��n(H2O)=
=0.01mol�������ٵ�ˮ������m(H2O)=2.41g-1.6g=0.81g��n(H2O)= ![]() =0.045mol��
=0.045mol��
CuSO4��xH2O![]() CuSO4+ xH2O
CuSO4+ xH2O
1 x
0.01mol 0.045mol
![]() =
=![]() �����x=4.5��
�����x=4.5��

 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�����Ŀ����ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�MgO��ʵ�鷽���� 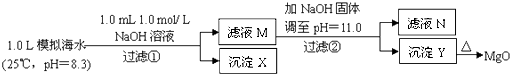
ģ�⺣ˮ�е� | Na+ | Mg2+ | Ca2+ | Cl�� | HCO3�� |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
ע����Һ��ij�����ӵ�Ũ��С��1.0��10��5 mol/L������Ϊ�����Ӳ����ڣ�ʵ������У�������Һ������䣮��֪��Ksp��CaCO3��=4.96��10��9��Ksp��MgCO3��=6.82��10��6��Ksp[Ca��OH��2]=4.68��10��6��Ksp[Mg��OH��2]=5.61��10��12 �� ����˵����ȷ���ǣ� ��
A.������XΪCaCO3
B.��ҺM�д���Mg2+ �� ������Ca2+
C.��ҺN�д���Mg2+��Ca2+
D.�����������Ϊ����4.2gNaOH���壬������YΪCa��OH��2��Mg��OH��2�Ļ����
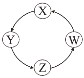
����Ŀ�����и��������У��������ͼʾ������һ��������һ��ת����ϵ�������
��� | X | Y | Z | W |
|
�� | Si | Na2SiO3 | H2SiO3 | SiO2 | |
�� | Na | NaOH | Na2CO3 | NaCl | |
�� | Cl2 | Ca(ClO)2 | HClO | HCl | |
�� | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. �٢ڢ� B. �٢ۢ� C. �ڢ� D. �٢�