题目内容
【题目】25℃时,CH3COONH4显中性.
Ⅰ.将0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合(混合后溶液的体积变化忽略不计)测得混合溶液的pH=9.回答下列问题:
(1)用离子方程式表示混合溶液的pH=9的原因: .
(2)混合溶液中c(CH3COOH)=mol/L(列式,不必化简).
(3)相同温度相同浓度的下列四种溶液:①(NH4)2CO3②CH3COONH4③(NH4)2SO4④NH4Cl,pH由大到小的顺序为:(填序号).
Ⅱ.Mg(OH)2沉淀可溶于NH4Cl溶液.同学们对有关该反应的原理的解释如下:甲同学认为是NH4Cl水解,溶液呈酸性,H+中和了Mg(OH)2电离出的OH﹣导致沉淀溶解;乙同学认为是NH4+与Mg(OH)2电离出的OH﹣反应生成弱电解质NH3H2O导致沉淀溶解.
(4)丙同学不能肯定哪位同学的解释合理,于是选用下列一种试剂来验证甲、乙两同学的观点,他选用的试剂是:
A.NH4NO3
B.CH3COONH4
C.Na2CO3
D.NH3H2O
(5)丙同学将所选试剂滴加到Mg(OH)2的悬浊液中,Mg(OH)2溶解,由此可知:(填“甲”或“乙”)的解释更为合理.Mg(OH)2沉淀与NH4Cl反应的离子方程式为: .
(6)现有Mg(OH)2和Al(OH)3沉淀的混合物,若要除去Al(OH)3得到纯净的Mg(OH)2 , 可用;若要除去Mg(OH)2得到纯净的Al(OH)3 , 可用;(写化学式)
【答案】
(1)CH3COO﹣+H2O?CH3COOH+OH﹣
(2)(1×10﹣5﹣1×10﹣9)
(3)①②④③
(4)B
(5)乙;Mg(OH)2+2 NH4+═Mg2++2NH3?H2O
(6)NH4NO3(或CH3COONH4等铵盐均可);NaOH溶液等
【解析】解:(1)等物质的量的醋酸和NaOH恰好完全反应生成醋酸钠,溶液呈碱性,说明醋酸是弱酸,醋酸根离子水解导致溶液呈碱性,水解方程式为CH3COO﹣+H2OCH3COOH+OH﹣ , 所以答案是:CH3COO﹣+H2OCH3COOH+OH﹣;(2)根据电荷守恒得c(CH3COO﹣)+c(OH﹣)=c(Na+)+c(H+),
根据物料守恒得c(Na+)=c(CH3COOH)+c(CH3COO﹣),
所以得c(CH3COOH)=c(OH﹣)﹣c(H+)= ![]() mol/L﹣10﹣9mol/L=(1×10﹣5﹣1×10﹣9)mol/L,
mol/L﹣10﹣9mol/L=(1×10﹣5﹣1×10﹣9)mol/L,
所以答案是:(1×10﹣5﹣1×10﹣9);(3)CH3COONH4溶液呈中性,说明CH3COO﹣水解程度和NH4+水解程度相同;CO32﹣水解程度大于CH3COO﹣ , 所以①溶液呈碱性;
②溶液呈中性;
③④中NH4+水解程度相同,两种溶液都呈酸性,但④中NH4+浓度大,所以pH③<④,
通过以上分析知,溶液pH大小顺序是①②④③,
所以答案是:①②④③;(4)硝酸铵和氯化铵相似,只有铵根离子的水解,而碳酸钠和氨水溶液都呈碱性,只有B符合,
所以答案是:B;(5)丙同学将所选试剂滴加到Mg(OH)2悬浊液中,Mg(OH)2溶解,说明氢氧化镁和铵根离子反应而使氢氧化镁溶解,离子方程式为Mg(OH)2+2 NH4+═Mg2++2NH3H2O,
所以答案是:乙;Mg(OH)2+2 NH4+═Mg2++2NH3H2O;(6)通过以上分析知,氢氧化镁溶于铵盐,但氢氧化不溶于铵盐,可以用铵盐除去氢氧化镁,如NH4NO3(或CH3COONH4等铵盐均可);氢氧化铝能溶于强碱,但氢氧化镁不溶于强碱,所以可以用强碱溶液除去氢氧化铝,如NaOH溶液等,
所以答案是:NH4NO3(或CH3COONH4等铵盐均可);NaOH溶液等.

【题目】根据所学知识回答下列问题
(1)以K、Na、H、O、S、N中任两种或三种元素组成合适物质,分别填在表中②、④、⑥后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④_______ | ⑤Na2SO4 ⑥_______ | ⑦CO2 ⑧SO3 | ⑨NH3 |
(2)写出①与少量的③溶液反应的离子方程式__________________________。
(3)写出铁与①溶液反应的化学方程式________________________________。
(4)某同学欲用10mol·L-1浓硫酸配制480 mL 1 mol·L-1的稀硫酸。配制480mL 1mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为_________mL。
【题目】海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案: 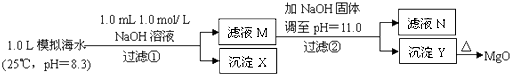
模拟海水中的 | Na+ | Mg2+ | Ca2+ | Cl﹣ | HCO3﹣ |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10﹣5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变.已知:Ksp(CaCO3)=4.96×10﹣9;Ksp(MgCO3)=6.82×10﹣6;Ksp[Ca(OH)2]=4.68×10﹣6;Ksp[Mg(OH)2]=5.61×10﹣12 . 下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+ , 不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2gNaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
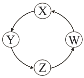
【题目】下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①②③ B. ①③④ C. ②③ D. ①④