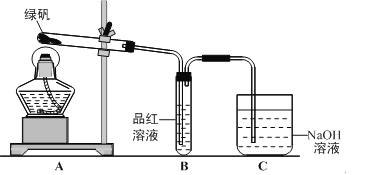
题目内容
【题目】在500℃时,把0.3mol SO2和0.2mol O2充入一个体积为10L并盛有V2O5(催化剂)的真空密闭容器中,保持温度不变,经2min后,容器内的压强不再变化,此时容器内压强减小20%。下列说法正确的是( )
A.该温度下此反应的平衡常数K=400
B.其他条件不变,再充入0.3mol SO2和0.2mol O2平衡时,SO2的体积分数增大
C.平衡时,SO2的转化率为95%
D.前2min SO2的平均反应速率0.02mol/(L·s)
【答案】A
【解析】
试题分析:根据理想气体状态方程可知,达到平衡状态时各物质的物质的量之和减小20%,即:
2SO2 + O2![]() 2SO3
2SO3
起始: 0.3 0.2 0
转化: 2x x 2x
平衡:0.3-2x 0.2-x 2x
则:0.3-2x+0.2-x+2x=(1-0.2)×(0.3+0.2)
解得:x=0.1,故平衡时SO2的物质的量为0.1mol,O2的物质的量为0.1mol,SO3的物质的量为0.2mol。
A.平衡常数K=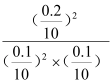 =400,A正确;B.可从等效平衡角度考虑,若再充入0.3mol SO2和0.2mol O2,保持压强不变,则平衡不移动,SO2的体积分数不变,为了保证体积不变,需要体积,则压强增大,平衡正向移动,SO2的体积分数减小,B错误;C.平衡时SO2的转化率为0.2/0.3=66.7%,C错误;D. 前2min SO2的平均反应速率为:v=
=400,A正确;B.可从等效平衡角度考虑,若再充入0.3mol SO2和0.2mol O2,保持压强不变,则平衡不移动,SO2的体积分数不变,为了保证体积不变,需要体积,则压强增大,平衡正向移动,SO2的体积分数减小,B错误;C.平衡时SO2的转化率为0.2/0.3=66.7%,C错误;D. 前2min SO2的平均反应速率为:v=![]() =0.01 mol/(L·min),D错误。故答案A。
=0.01 mol/(L·min),D错误。故答案A。

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目