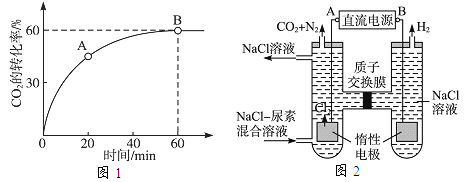
��Ŀ����
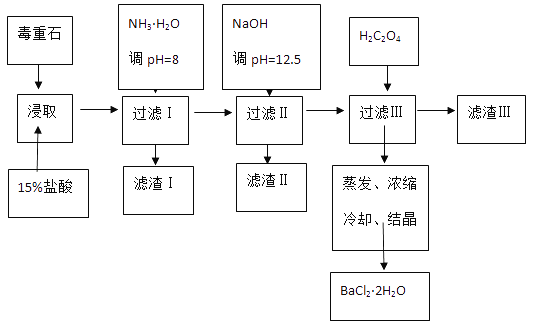
����Ŀ������ʯ����Ҫ�ɷ�BaCO3����Ca2+��Mg2+��Fe3+�����ʣ���ʵ�������ö���ʯ�Ʊ�BaCl22H2O���������£�
��1��ʵ������37%����������15%�����ᣬ����Ͳ���ʹ�����������е�_________��
a.�ձ� b.����ƿ c.������ d.�ζ���
��2������NH3H2O����pH=8�ɳ�ȥ_______�������ӷ��ţ����������к�________���ѧʽ��������H2C2O4ʱӦ���������ԭ����___________��
Ca2+ | Mg2+ | Fe3+ | |
��ʼ����ʱ��pH | 11.9 | 9.1 | 1.9 |
��ȫ����ʱ��pH | 13.9 | 11.1 | 3.2 |
��BaC2O4����Һ�м���CaCl2���ɷ��������IJ���ת������д����Ӧ�����е����ӷ���ʽ___________________������÷�Ӧ��ƽ�ⳣ��K=___________��Ksp��BaC2O4��=1.6��10-7��Ksp��CaC2O4��=2.3��10-9������һλС����
��3�����ü�����ζ����ɲⶨBa2+�ĺ�����ʵ����������С���֪��2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4��
���������ƶ�x mLһ��Ũ�ȵ�Na2CrO4��Һ����ƿ�У��������ָʾ������b molL-1�����Һ�ζ����յ㣬��õμ��������ΪV0mL��
����������ȡy mL BaCl2��Һ����ƿ�У�����x mL�벽������ͬŨ�ȵ�Na2CrO4��Һ����Ba2+��ȫ�������ټ������ָʾ������b molL-1�����Һ�ζ����յ㣬��õμ���������ΪV1mL�������������ݣ��ɼ����BaCl2��ҺŨ��Ϊ_________molL-1���ú���ĸ��ʽ�ӱ�ʾ�������������еμ�����ʱ����������Һ��������Ba2+Ũ�ȵIJ���ֵ��_______������ƫ��������ƫС������
���𰸡� ac Fe3+ Mg��OH��2��Ca��OH��2 H2C2O4�����ᵼ������BaC2O4��������Ʒ�IJ������� BaC2O4+Ca2+= CaC2O4+Ba2+ 69.6 ![]() ƫ��
ƫ��
��������(1)��Һ����������= ��100%��ʵ������37%����������15%�����ᣬ������Ũ����������ˮ�������������Ͳ��ȡ��Ũ����ϡ��Ϊϡ���ᣬ�����ձ���Ϊ����ϡ��ѡ��a����������������ܽ�ѡ��c���ʴ�Ϊ��ac��
��100%��ʵ������37%����������15%�����ᣬ������Ũ����������ˮ�������������Ͳ��ȡ��Ũ����ϡ��Ϊϡ���ᣬ�����ձ���Ϊ����ϡ��ѡ��a����������������ܽ�ѡ��c���ʴ�Ϊ��ac��
(2)��������ͼ�ͱ������ݿ�֪��Fe3+��ȫ����ʱ��pHΪ3.2�����백ˮ����pHΪ8��Fe3++3NH3H2O=Fe(OH)3��+3NH4+��Fe3+��ȫ����������IΪFe(OH)3�������������Ƶ���pH=12.5��Ca2+��ȫ����ʱ��pHΪ13.9��Mg2+��ȫ����ʱ��pHΪ11.1��Mg2+��ȫ������Ca2+���ֳ������������к�Mg(OH)2��Ca(OH)2����Һ����Ҫ��Ca2+��Ba2+��Ksp(BaC2O4)=1.6��10-7��Ksp(CaC2O4)=2.3��10-9�����γ�CaC2O4����������H2C2O4ʱӦ�����������ֹCaC2O4������ȫ������H2C2O4�ᵼ������BaC2O4��������Ʒ�IJ������٣���BaC2O4����Һ�м���CaCl2���ɷ��������IJ���ת������Ӧ�����е����ӷ���ʽΪBaC2O4+Ca2+= CaC2O4+Ba2+����Ӧ��ƽ�ⳣ��K=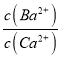 =
=![]() =
=![]() =69.6���ʴ�Ϊ��Fe3+��Mg(OH)2��Ca(OH)2��H2C2O4�����ᵼ������BaC2O4��������Ʒ�IJ������٣�BaC2O4+Ca2+= CaC2O4+Ba2+��69.6��
=69.6���ʴ�Ϊ��Fe3+��Mg(OH)2��Ca(OH)2��H2C2O4�����ᵼ������BaC2O4��������Ʒ�IJ������٣�BaC2O4+Ca2+= CaC2O4+Ba2+��69.6��
(3)�����Ba2+��ȫ�������ټ������ָʾ������b molL-1�����Һ�ζ����յ㣬��õμ���������ΪV1mL������2CrO42-+2H+�TCr2O72-+H20 ����������ʵ���Ϊ��V1��10-3��bmol���������b molL-1�����Һ�ζ����յ㣬��õμ��������ΪV0mL�����������������ʵ�����V0��10-3��bmol��Ba2++CrO42-�TBaCrO4������Ba2+��Ӧ��CrO42-�����ʵ���ΪV0��10-3��bmol-V1��10-3��bmol=(V0-V1)b��10-3mol���������ȡy mLBaCl2��Һ����ƿ�У�����BaCl2��Һ��Ũ��Ϊ�� ![]() mol/L=
mol/L=![]() mol/L����������еμ�����ʱ����������Һ������V1��С����Ba2+Ũ�Ȳ���ֵ��ƫ�ʴ�Ϊ��
mol/L����������еμ�����ʱ����������Һ������V1��С����Ba2+Ũ�Ȳ���ֵ��ƫ�ʴ�Ϊ�� ![]() ��ƫ��
��ƫ��

����Ŀ���л��Ļ�ԴԶ������������ӻ�ѧ���ӽǿ�,�������������ǣ� ��
A | B | C | D | |
�л� �Ļ� | ��ǧ�����������࣬������ɳʼ����--������������ɳ�� | ���칤�������ƪ��ұ�������أ������ƣ���������ǯΪ�档������֮˵Ҳ���� | �����������(n��u)�� |
��°� |
�ӻ�ѧ ���ӽ� ���� | ʫ���еġ��ԡ������൱�ڷ����ᴿ�����еġ����ˡ� | ��ǯ����ָ��Ϊ����¯������¯������ | ���˲���ǰ�ȷ�ȥ��ľ�յ�Ұ�ݣ�����ҿ��Է�������Խ����������� | �ҹ���ѧ��ҵ�ĵ����,��Ҫ�ɾ�: �����Ƽ,�ü�ָ���Ǵ��� |
A. A B. B C. C D. D