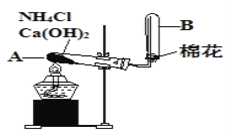
题目内容
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s) + CO2(g)![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
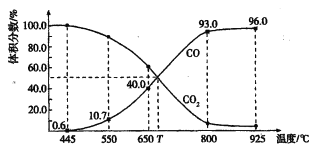
已知:气体分压(P分)=气体总压(p总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,V正、V逆均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为40.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= 23. 04p总
【答案】D
【解析】A,550℃,若充入惰性气体,容器的压强不变,容器的体积增大,相当于减小压强,υ正、υ逆均减小,平衡向正反应方向移动,A项错误;B,由图知650℃时,CO的体积分数为40%,CO2的体积分数为60%,平衡时n(CO2):n(CO)=60%:40%=3:2,设CO2平衡物质的量为3mol,CO平衡物质的量为2mol,生成2molCO消耗1molCO2,反应达到平衡时CO2的转化率为![]() 100%=25%,B项错误;C,T℃平衡时CO与CO2的体积分数相等,若充入等体积的CO2和CO即为平衡状态,平衡不移动,C项错误;D,925℃时CO的体积分数为96%,CO2的体积分数为4%,CO的分压为0.96p总,CO2的分压为0.04p总,用平衡分压代替平衡浓度表示的化学平衡常数Kp=(0.96p总)2
100%=25%,B项错误;C,T℃平衡时CO与CO2的体积分数相等,若充入等体积的CO2和CO即为平衡状态,平衡不移动,C项错误;D,925℃时CO的体积分数为96%,CO2的体积分数为4%,CO的分压为0.96p总,CO2的分压为0.04p总,用平衡分压代替平衡浓度表示的化学平衡常数Kp=(0.96p总)2![]() (0.04p总)=23.04p总;答案选D。
(0.04p总)=23.04p总;答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解错误的是( )
A | B | C | D | |
中华 文化 | “千淘万漉虽辛苦,吹尽狂沙始到金”--刘禹锡《浪涛沙》 | 《天工开物》锤锻篇(冶铁)记载:“谚云,‘万器以钳为祖。’非无稽之说也。” | 成语“刀耕火耨(nòu)” |
侯德榜 |
从化学 的视角 理解 | 诗句中的“淘、漉”相当于分离提纯操作中的“过滤” | “钳”是指作为熔铁炉、加热炉的坩埚 | 古人播种前先伐去树木烧掉野草,用余灰可以肥田,还可以降低土壤碱性 | 我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是纯碱 |
A. A B. B C. C D. D
【题目】用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
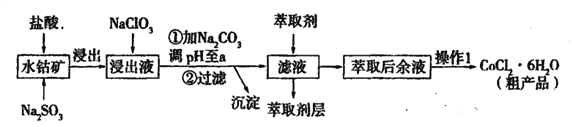
已知:①浸出液含有的阳离子主要有,H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe( OH)3 | Fe(OH)2 | Co(OH)2 | Al( OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)①浸出过程中加入Na2SO3的目的是____。
②向浸出液中加入NaClO3的离子反应方程式为____。
③为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施____(答一条即可)。若不慎向“浸出液”中加入NaClO3过量时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(2)①“加Na2CO3调pH至a”,过滤所得到的沉淀成分为____。
②萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____;其使用的适宜pH范围是____(填编号)。
A.2.0—2.5 B. 3.0—3.5 C.4.0—4.5 D.5.0—5.5

③“操作1”中包含的基本实验操作,它们依次是_______、____和过滤、减压烘干。
(3)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤,洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____(答一条即可)。