题目内容
(16分)Ⅰ.硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下: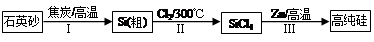
(1)焦炭在过程Ⅰ中做 剂。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的化学方程式为 。
(3)整过生产过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应方程式为 。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是 。
(4)Zn还原SiCl4的反应如下:
反应①:400℃~756℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(l) △H1<0
Si(S)+2ZnCl2(l) △H1<0
反应②:756℃~907℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(g) △H2<0
Si(S)+2ZnCl2(g) △H2<0
反应③:907℃~1410℃,SiCl4(g)+2Zn(g) Si(S)+2ZnCl2(g) △H3<0
Si(S)+2ZnCl2(g) △H3<0
i. 反应②的平衡常数表达式为 。
ii. 对于上述三个反应,下列说明合理的是 。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应速率 d.Na、Mg可以代替Zn还原SiCl4
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,可用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化成H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程 。
Ⅱ.(1)甲烷、氢气、一氧化碳的燃烧热分别为akJ·mol-1,bkJ·mol-1,ckJ·mol-1,工业上利用天燃气和二氧化碳反应制备合成气(CO、H2),其热化学反应方程式为 。
(2)已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,三种难溶盐的饱和溶液中,Ag+浓度大小的顺序为 。
Ⅰ.(1)还原剂(1分) (2)2NaCl+H2O电解2NaOH+Cl2↑+H2↑(2分)
(3)①SiCl4+2H2O=SiO2+4HCl(2分)
②使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性(1分),同时降低放出的热量(1分)。i. K= (1分) ii. b c d(完全正确2分,选一个正确1分,有错为零分)
(1分) ii. b c d(完全正确2分,选一个正确1分,有错为零分)
(5)SiO2+6HF=H2SiF6+2H2O(2分)
Ⅱ.(1)CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-(a-2b-2c)KJ/mol(2分)
(2)Ag2CrO4>AgCl>AgI(2分)
解析试题分析:(1)碳在高温下与二氧化硅反应生成CO和硅,碳元素化合价升高,被氧化,作还原剂,因此焦炭在过程Ⅰ中做还原剂。
(2)电解饱和食盐水生成氢氧化钠、氢气和Cl2,反应的化学方程式为2NaCl+H2O电解2NaOH+Cl2↑+H2↑。
(3)①①SiCl4遇水剧烈水解生成SiO2和一种酸,根据原子守恒可知该酸应该是盐酸,则反应的化学方程式为SiCl4+2H2O=SiO2+4HCl。
②如果不降低温度,则水蒸气会被浓硫酸稀释,降低浓硫酸的性能,所以冷却的作用是使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量。
(4)i. 化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,又因为固体或纯液体不能表示平衡常数,因此反应②的平衡常数表达式为K= 。
。
ii.a.正方应是放热反应,升高温度平衡向逆反应方向移动,则会降低SiCl4的转化率,a不正确;b.由于锌是活泼的金属,即使存在氧气,也不会与硅反应,而是与锌反应,因此还原过程需在无氧的气氛中进行,b正确;c.正方应是体积减小的可逆反应,则增大压强平衡向正反应方向移动,能提高反应速率,c正确;d.Na、Mg的活泼性均强于锌,可以代替Zn还原SiCl4,d正确,答案选bcd。
(5)根据原子守恒可知,反应中还有水生成,则反应的化学方程式为SiO2+6HF=H2SiF6+2H2O。
Ⅱ.(1)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以甲烷、氢气、一氧化碳完全燃烧的热化学方程式分别为①CH4(g)+ O2(g)=CO2(g)+2H2O(l)△H=-a kJ/mol、②2CO(g)+ O2(g)=2CO2(g)△H=-2b kJ/mol、③O2 (g)+2H2(g)=2H2O(l)△H=-2c kJ/mol,所以根据盖斯定律可知①-(②+③)即得到CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-(a-2b-2c)KJ/mol。
(2)由ksp表达式可知AgCl中c(Ag+)= ,AgI中c(Ag+)=
,AgI中c(Ag+)=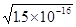 ,Ag2CrO4中Ag+为x,则
,Ag2CrO4中Ag+为x,则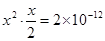 ,解得
,解得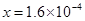 ,所以Ag+浓度大小的顺序为Ag2CrO4>AgCl>AgI。
,所以Ag+浓度大小的顺序为Ag2CrO4>AgCl>AgI。
考点:考查二氧化硅提纯反应条件可知、外界条件对反应速率和平衡状态的影响、热化学方程式书写以及溶解平衡应用等

 阅读快车系列答案
阅读快车系列答案在一定体积的密闭容器中,进行如下反应:A(g) B(g)+C(g),其化学平衡常数K和温度t的关系如下表所示:
| toC | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应化学平衡常数的表达式:K= 。
(2)在下图中用实线画出该反应的能量变化曲线,同时在此基础上用虚线画出加入催化剂后的能量变化曲线。

(3)一定温度和体积下,下列说法中能说明该反应达平衡状态的是 。
①容器内压强不变
②混合气体中c(C)不变
③混合气体的密度不变
④v(A)=v(B)
⑤化学平衡常数K不变
⑥混合气体平均式量不变
(4)反应时间(t)与容器内气体A的浓度数据见下表
| 时间t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 |
| C(A)/(mol·L-1) | 10.4 | 8.6 | 7.5 | 6.6 | 5.9 | 5.5 | 5.5 |
回答下列问题:
①2~4min内,B的平均速率为 。
②反应达平衡时,A的转化率为 。
③欲提高A韵平衡转化率,可以采取的措施有 。
工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
|
|
|
|

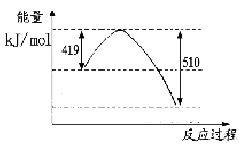 写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。该反应的△S____0(填“>”或“<”或“=”),在 ______情况下有利于该反应自发进行。
(2)如果上述反应方程式的平衡常数K值变大,则该反应__ (选填编号)。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是 __ (选填编号)。
A.3v正(H2)=v逆(CO2) B.C(H2) = C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
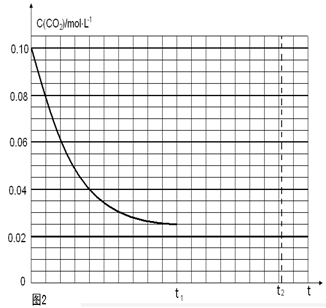
(4)若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了2.0g/L,在这段时间内CO2的平均反应速率为 。反应在t1时达到平衡,过程中c(CO2)随时间t变化趋势曲线右图所示。保持其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
(19分)钒有金属“维生素”之称,研究发现钒的某些化合物对治疗糖尿病有很好的疗效。
工业上设计将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤②、③的变化过程可表示为(HM为有机萃取剂):
VOSO4 (水层)+ 2HM(有机层) VOM2(有机层) + H2SO4 (水层)
VOM2(有机层) + H2SO4 (水层)
步骤②中萃取时必须加入适量碱,其原因是 。
步骤③中X试剂为 。
(2)步骤④的离子方程式为
(3)该工艺流程中,可以循环利用的物质有 和 。
(4)操作Ⅰ得到的废渣,用 溶解,充分反应后, ,(填写系列操作名称)称量得到mg氧化铜。
(5)为了制得氨水,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为① |
| 乙小组 | ② | 浓氨水、氢氧化钠固体 | 分析产生氨气的原因③ |
 2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:① 用物质 A 表示的反应的平均速率 ② 2 s 时物质 B 的浓度为 。
2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:① 用物质 A 表示的反应的平均速率 ② 2 s 时物质 B 的浓度为 。 CO2(g)+H2(g)
CO2(g)+H2(g)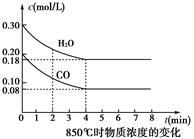
 2SO3(g);
2SO3(g);



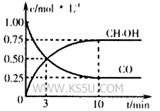
 的化学平衡常
的化学平衡常 。
。
