题目内容
在一个容积固定的反应器中,有一可左右滑动的密封隔板,左、右两侧分别进行如下可逆反应:2SO2(g)+O2(g) 2SO3(g);
2SO3(g);
3Fe(s)+4H2O(g)  Fe3O4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。
Fe3O4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。
当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处。请填写以下空白:
(1)若x=1.5,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行。欲使反应维持向该方向进行,则x的取值范围是________________。
(2)若x=2,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行,平衡时混合气中SO2所占的体积分数为_________。
(1)逆反应 1.25<x<1.75 (2)正反应 25%
解析试题分析:(1)这两个平衡体系的特点是:第一个反应前后气体的总物质的量发生变化,第二个保持不变,故右边永远是9mol气体,同在一个容器中,同温同压,故气体的物质的量之比等于体积之比。故平衡时,左边为6mol气体;当x=1.5时,左边现在总的物质的量为5.75mol<6mol,故向逆反应方向进行;若保持该方向,1.25<x<1.75;
(2)根据上述,反应向正反应方向进行了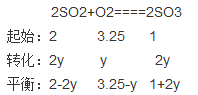
平衡总物质的量为6mol,即 2-2y+3.25-y +1+2y= 6mol,解之,得y =0.25mol,2-2y =1.5,二氧化硫的体积分数="1.5/6=25%" ;
考点:化学平衡
点评:化学平衡是历年高考重中之重,考生一定要系统备考此知识点。难度较大。

 小题狂做系列答案
小题狂做系列答案硫元素的化合物在生产、生活中有着广泛的应用。
(1)400℃,1.01×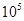 Pa下,容积为1.0L的密闭容器中充入0.5molSO2, (g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2, (g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g) △H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
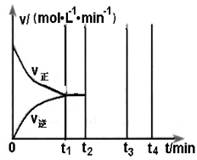
2SO3(g) △H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示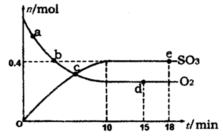 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
| A.a点时刻的正反应速率比b点时刻的大 |
| B.c点时刻反应达到平衡状态 |
| C.d点和e点时刻的c(O2)相同 |
| D.若5 00℃,1.01×105Pa下,反应达到平衡时,n( SO3) 比图中e点时刻的值大 |
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如下:
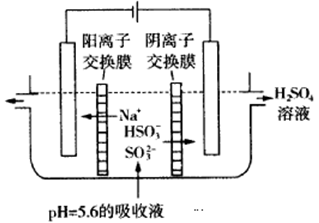
HSO3-在阳极室反应的电极反应式为________________________,阴极室的产物_________________。
 反应过程中能量示意图。
反应过程中能量示意图。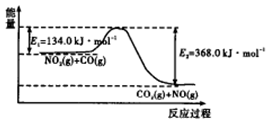

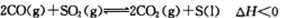 可以实现燃煤烟气中硫的回收。某研究小组向2L某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中通入CO和SO2,10分钟后测得容器CO2的物质的量为0.9mol。
可以实现燃煤烟气中硫的回收。某研究小组向2L某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中通入CO和SO2,10分钟后测得容器CO2的物质的量为0.9mol。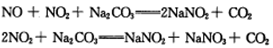
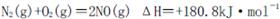 是导致汽车尾 气中含有NO的重要原因之一。
是导致汽车尾 气中含有NO的重要原因之一。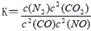 ,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表
,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表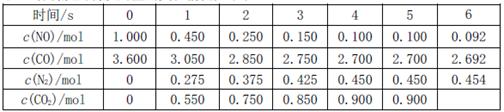
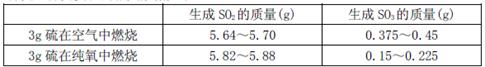
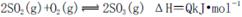 向右移动
向右移动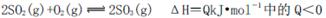
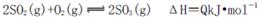 向右移动
向右移动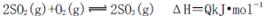 向右移动
向右移动 3C(g),2分钟达到平衡,生成1.5 mol
3C(g),2分钟达到平衡,生成1.5 mol 
 Si(S)+2ZnCl2(l) △H1<0
Si(S)+2ZnCl2(l) △H1<0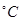 时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g)
时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。
2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。