��Ŀ����
��һ��������ܱ������У��������·�Ӧ��A��g�� B��g��+C��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���ʾ��
| toC | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ��ѧƽ�ⳣ���ı���ʽ��K= ��
��2������ͼ����ʵ�����÷�Ӧ�������仯���ߣ�ͬʱ�ڴ˻����������������������������仯���ߡ�

��3��һ���¶Ⱥ�����£�����˵������˵���÷�Ӧ��ƽ��״̬���� ��
��������ѹǿ����
�ڻ��������c��C������
�ۻ��������ܶȲ���
��v��A��=v��B��
�ݻ�ѧƽ�ⳣ��K����
�������ƽ��ʽ������
��4����Ӧʱ�䣨t��������������A��Ũ�����ݼ��±�
| ʱ��t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 |
| C��A��/��mol��L��1�� | 10.4 | 8.6 | 7.5 | 6.6 | 5.9 | 5.5 | 5.5 |
�ش��������⣺
��2��4min�ڣ�B��ƽ������Ϊ ��
�ڷ�Ӧ��ƽ��ʱ��A��ת����Ϊ ��
�������A��ƽ��ת���ʣ����Բ�ȡ�Ĵ�ʩ�� ��
��1��c(B)��c(C)/c(A)��2�֣�
��2�� 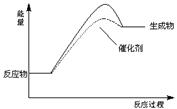 ��3�֣�
��3�֣�
��3���٢ڢޣ�3�֣�
��4����0.45 mol/(L��min)��2�֣� �� 47.1%��2�֣� �������¶Ȼ��СB��C��Ũ�ȣ�2�֣�
���������������2��ʹ�ô�����ܽ��ͣ�����ʼ�������䣻��3�����������ƽ�⣬��������ѹǿ�DZ������䲻�� ��ʾ��Ӧƽ�⣬��ȷ�� ����ϵ��ÿһ�ֳɷֵ������DZ�����c��C�������ʾ��Ӧƽ�⣬��ȷ��
�ۻ��������������䣬����̶����ʻ��������ܶ��Ǻ��������ܷ�Ӧ����Ӧ�����淴Ӧ������ȣ�v��A��=v��B��ֻ�DZ�ʾ���������¶�һ������ѧƽ�ⳣ��K���� ������ �������ƽ��ʽ������������ʵ����ɷ��ȣ��DZ�������ȷ����4�����ݹ�ʽֱ�Ӽ����0.45 mol/(L��min) �� 47.1%���������A��ƽ��ת���ʣ���ʹ���Բ�ȡ�Ĵ�ʩ�������¶Ȼ��СB��C��Ũ�Ȼ��Сѹǿ��
���㣺���黯ѧƽ���뷴Ӧ�����й����⡣

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
��1����ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����ں��������У��÷�Ӧ���Ȼ�ѧ����ʽΪ��
CO(g)��2H2(g)  CH3OH(g)����H1����116 kJ��mol��1
CH3OH(g)����H1����116 kJ��mol��1
�����д�ʩ����˵����Ӧ�ﵽƽ��״̬����___________
| A����ϵѹǿ���ֲ��� |
| B�����������ܶȱ��ֲ��� |
| C��CO��H2��Ũ��֮��Ϊ1��2 |
| D����λʱ���ڣ�����2molH2��ͬʱ����1mol CH3OH |
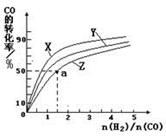
��2����֪�� CO(g)+
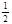 O2(g)=CO2(g) ��H2����283 kJ��mol-1 H2(g)+
O2(g)=CO2(g) ��H2����283 kJ��mol-1 H2(g)+ 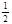 O2(g)=H2O(g) ��H3����242 kJ��mol-1
O2(g)=H2O(g) ��H3����242 kJ��mol-1���ʾ1mol��̬�״���ȫȼ������CO2��ˮ�������Ȼ�ѧ����ʽΪ��__________
�ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
| �� �ȣ��棩 | 360 | 440 | 520 |
| Kֵ | 0.036 | 0.010 | 0.0038 |
��1����д����ҵ�ϳɰ��Ļ�ѧ����ʽ ��
�����ϱ����ݿ�֪�÷�ӦΪ���ȷ�Ӧ�������� ��
�������ϣ�Ϊ������ƽ��ʱH2��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��������ţ�
a������ѹǿ b��ʹ�ú��ʵĴ���
c�������¶� d����ʱ����������е�NH3
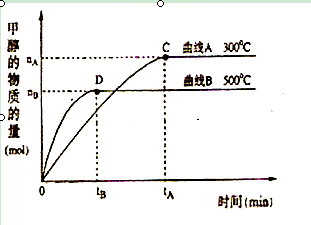
��2��ԭ����H2��ͨ����Ӧ CH4(g)+H2O (g)
 CO(g)+3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ�����
CO(g)+3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
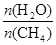 �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��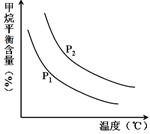
��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1 P2�����������=����������
�ڸ÷�ӦΪ ��Ӧ������ȡ����ȡ�����
��3��ԭ����H2����ͨ����ӦCO(g)+H2O(g)
 CO2 (g)+H2(g) ��ȡ��
CO2 (g)+H2(g) ��ȡ����T ��ʱ�����ݻ��̶�Ϊ5 L�������г���1 molˮ������1 mol CO����Ӧ��ƽ����CO��Ũ��
Ϊ0.08 mol��L-1����ƽ��ʱCO��ת����Ϊ �����¶��·�Ӧ��ƽ�ⳣ��KֵΪ ��
�ڱ����¶���ΪT �棬�ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵
����ϵ����ƽ��״̬���� ������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n (CO) : n (H2O) : n (CO2) : n (H2)��1 : 16 : 6 : 6
�ҹ��зḻ����Ȼ����Դ������Ȼ��Ϊԭ�Ϻϳ����ص���Ҫ��������ͼ��ʾ��ͼ��ijЩת�����輰������δ�г�����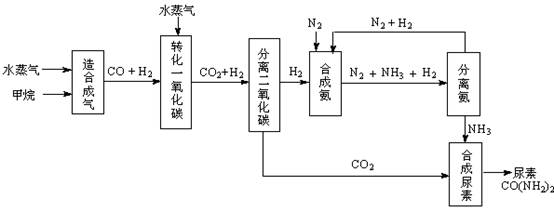
��1������ϳ������������Ȼ�ѧ����ʽ��CH4(g)+H2O(g) 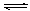 CO(g)+3H2(g)����H��0
CO(g)+3H2(g)����H��0
�ں��º��ݵ������£������CH4�ķ�Ӧ���ʺ�ת���ʣ����д�ʩ���е��� ��
A������ѹǿ B�������¶� C������He�� D������ˮ����Ũ��
��2����ת��һ����̼�������ķ���ʽ��H2O(g) +CO(g) 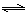 H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
�����̼��[ n��H2O��/n��CO��]��Kֵ ������������䡱��С���������÷�Ӧ��400��ʱ���У���ʼͨ������ʵ�����H2O��CO����Ӧ���е�ijһʱ��ʱCO��CO2��Ũ�ȱ�Ϊ1��3����ʱv������ v���棩�����������������������
��3���йغϳɰ���ҵ��˵������ȷ���� ��
A���÷�Ӧ�����˹��̵�
B���ϳɰ���ҵ��ʹ�ô�������߷�Ӧ���������
C���ϳɰ���Ӧ�¶ȿ�����500�����ң�Ŀ����ʹ��ѧƽ��������Ӧ�����ƶ�
D���ϳɰ���ҵ����ѭ����������Ҫԭ����Ϊ�˼ӿ췴Ӧ����
��4���������ع����У�������n(NH3)��n(CO2)��������Ϊ ����ʵ�����������У�����ʹn(NH3)��n(CO2)��3��������Ϊ ��
��5��������ϳɰ�����ת����Ϊ60��ʱ����3.0��108 L����Ϊԭ���ܹ��ϳ� L ������������������ڱ�״���²ⶨ��
һ���¶��£���1.0L�ܱ������м���0.60molX(g)��������ӦX(g)  Y(s)+2Z(g)��H��0��÷�Ӧ��XŨ���뷴Ӧʱ����������±�
Y(s)+2Z(g)��H��0��÷�Ӧ��XŨ���뷴Ӧʱ����������±�
| ��Ӧʱ��t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
| c(X)/(mol��L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
��1��3minʱ��Z��ʾ��ƽ����Ӧ����v(Z)�� ��
��2�������÷�Ӧ�з�Ӧ���Ũ����ʱ��Ĺ��ɣ��ó��Ľ����� ���ɴ˹����Ƴ���Ӧ��6minʱ��Ӧ���Ũ��aΪ mol��L-1��
��3����Ӧ���淴Ӧ������ʱ��仯�Ĺ�ϵ��ͼ��t2ʱ�ı���ijһ���������ı������������ �� ����д������
��4��������Щ��������������Ѵ�ƽ��״̬ ������ĸ��ţ�
A���������һ��ʱ�����ܶȲ��ٱ仯
B����Ӧ��ƽ�ⳣ�����ٱ仯
C�������������ƽ����Է�����������ʱ����仯
D��Y�����ʵ������ٷ����仯
E��Z���������ʵ���X���������ʵ�2��
 2NH3(g) ��H = -92 kJ��mol-1
2NH3(g) ��H = -92 kJ��mol-1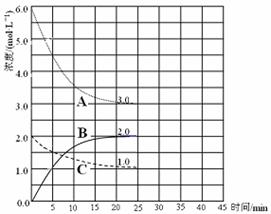
 ��Ӧ����������ʾ��ͼ��
��Ӧ����������ʾ��ͼ��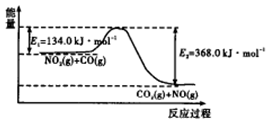

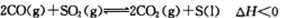 ����ʵ��ȼú��������Ļ��ա�ij�о�С����2Lij�ܱյ������������������������䣬��������������Բ��ƣ���ͨ��CO��SO2��10���Ӻ�������CO2�����ʵ���Ϊ0.9mol��
����ʵ��ȼú��������Ļ��ա�ij�о�С����2Lij�ܱյ������������������������䣬��������������Բ��ƣ���ͨ��CO��SO2��10���Ӻ�������CO2�����ʵ���Ϊ0.9mol��

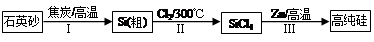
 Si(S)+2ZnCl2(l) ��H1��0
Si(S)+2ZnCl2(l) ��H1��0