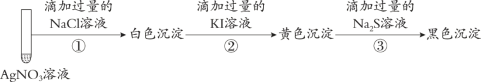
题目内容
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下:
已知:![]() +CH3Cl
+CH3Cl![]()
![]() +HCl
+HCl
请回答下列问题:
(1)F的名称是_______,⑥的反应类型是________;
(2)W的结构简式为_____________;
(3)反应②的化学方程式是____________;
(4)反应③的化学方程式是_____________。
【答案】苯甲醇 取代(酯化)反应 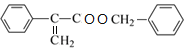
 +2NaOH
+2NaOH![]()
 +2NaBr 2
+2NaBr 2 +O2
+O2![]() 2
2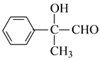 +2H2O
+2H2O
【解析】
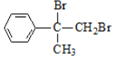
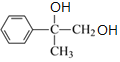
由流程可知,①为加成反应,由B的结构可知A为![]() ,B中含-Br,因此②为水解反应生成C,C为
,B中含-Br,因此②为水解反应生成C,C为 ,C催化氧化后,继续氧化生成D,D为
,C催化氧化后,继续氧化生成D,D为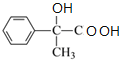 ,D在浓硫酸存在时脱水生成E,E为
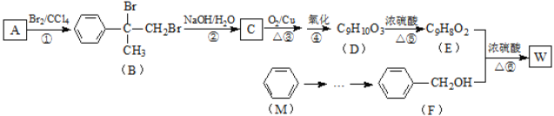
,D在浓硫酸存在时脱水生成E,E为![]() ,E与F发生酯化反应生成W,W为
,E与F发生酯化反应生成W,W为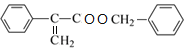 ,由信息
,由信息![]() 可知,先由苯制备甲苯,甲苯再与氯气光照下发生侧链取代,再水解生成醇,据此可以由M合成F,据此分析解答。
可知,先由苯制备甲苯,甲苯再与氯气光照下发生侧链取代,再水解生成醇,据此可以由M合成F,据此分析解答。
(1)F为![]() ,名称是苯甲醇;⑥为羧酸和醇的酯化反应,也属于取代反应,故答案为:苯甲醇;酯化反应或取代反应;
,名称是苯甲醇;⑥为羧酸和醇的酯化反应,也属于取代反应,故答案为:苯甲醇;酯化反应或取代反应;
(2)根据上述分析,W的结构简式为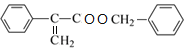 ,故答案为:
,故答案为: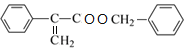 ;
;
(3)反应②为卤代烃的水解反应,反应的化学方程式为 +2NaOH
+2NaOH![]()
 +2NaBr,故答案为:
+2NaBr,故答案为: +2NaOH
+2NaOH![]()
 +2NaBr;
+2NaBr;
(4)反应③为醇的催化氧化,化学方程式为2 +O2
+O2![]() 2
2 +2H2O,故答案为:2
+2H2O,故答案为:2 +O2
+O2![]() 2
2 +2H2O。
+2H2O。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】下列说法中不正确的是( )
弱酸 | CH3COOH | HClO | H2CO3 |
电离平衡常数(25℃) | K1=1.760×10-5 | K1=2.95×10-8 | K1=4.30×10-7 K2=5.60×10-11 |
A.pH相同的①CH3COONa ②NaHCO3③NaClO三种溶液中c(Na+):③<②<①
B.一定浓度的NaHS溶液中:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
C.pH=a的氨水,稀释至原体积的10倍后,其pH=b,则b>a-1
D.少量的![]() 通入NaClO溶液中发生反应:
通入NaClO溶液中发生反应:![]()
【题目】某同学为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况下的体积),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)反应速率最大的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(2)反应速率最小的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(3)2~3min时间段内,以盐酸的浓度变化表示该反应的速率为__。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在盐酸中分别加入等体积的下列液体,你认为可行的是__(填序号)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液