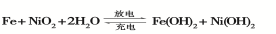题目内容
如图为相互串联的甲、乙两电解池。试回答:
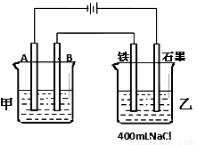
(1)若甲电解池利用电解原理在铁上镀铜,则A是 、 (填电极材料和电极名称),电极反应是 ;B是(要求同A) 、 ,电极反应是 ,应选用的电解质溶液是 ;乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色。
(2)若甲电解池阴极增重1.28g,乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol/L,溶液的pH等于 。
(3)若甲电解池以I=0.21A的电流电解60min后阴极增重0.25g,则此实验测得的阿伏加德罗常数NA为多少(已知电子电量e—=1.60×10—19C)?(简要写计算过程)
(1)铁; 阴极; Cu2++2e-=Cu;铜;阳极;Cu2+—2e-=Cu2+ 含Cu2+的溶液(或可溶性铜盐皆可);红;
(2)0.1; 13
(3)NA =6.05×1023mol—1
【解析】
试题分析:(1)根据电源正负极可确定电极名称和电极上发生的反应。
(2)甲电解池阴极增重1.28g,转移的电子数0.04mol, 新生成溶质的物质的量0.04mol,c=0.1 mol/L, 溶液的pH等于13.
(3)根据电量守恒,电路中通过的物理电量等于电解时发生氧化还原反应中两极上转移的电子的化学电量。所以有:
Q=It=2×NA×1.60×10—19 C×0.25g/64g·mol—1
It=0.21A×60×60s
NA =6.05×1023mol—1
考点:电解原理的应用。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目