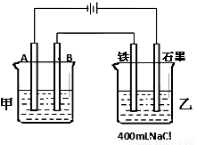
题目内容
常温下,用0.1000mol/LNaOH溶液分别滴定25.00mL0.1000mol/L盐酸溶液和
25.00mL0.1000mol/LCH3COOH溶液,滴定过程中pH变化曲线如下图所示。下列判断不正确的是
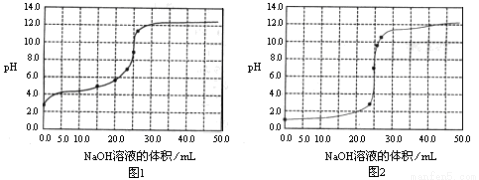
A.滴定盐酸的pH变化曲线为图2
B.在滴定CH3COOH溶液的过程中,始终都有c(Na+)+ c(H+)=c(CH3COO–)+c(OH–)
C.滴定CH3COOH溶液的过程中,当滴加12.5mLNaOH溶液时,溶液中离子浓度由大到小的顺序为c(CH3COO–)>c(Na+)>c(H+)>c(OH–)
D.当c(Na+)=c(CH3COO–)+ c(CH3COOH)时,溶液的pH<7
D
【解析】
试题分析:A、盐酸是强酸,0.1mol/L的盐酸溶液中pH=1,所以滴定盐酸的pH变化曲线为图2,A正确;B、根据电荷守恒可知,在滴定CH3COOH溶液的过程中,始终都有c(Na+)+ c(H+)=c(CH3COO–)+c(OH–),B正确;C、根据图①可知,滴定CH3COOH溶液的过程中,当滴加12.5mLNaOH溶液时,溶液显酸性,这说明醋酸的电离程度大于醋酸钠的水解程度,则溶液中离子浓度由大到小的顺序为c(CH3COO–)>c(Na+)>c(H+)>c(OH–),C正确;D、根据物料守恒可知,当醋酸与氢氧化钠恰好反应生成醋酸钠时,溶液中c(Na+)=c(CH3COO–)+ c(CH3COOH),此时溶液的pH>7,D不正确,答案选D。
考点:考查酸碱中和反应曲线、溶液酸碱性判断以及溶液中离子浓度大小比较

 小题狂做系列答案
小题狂做系列答案Ⅰ.(1)已知某有机物A只含有C、H、O三种元素,通过元素分析知含碳54.55%,含氢9.10%。质谱分析其相对分子质量为88,经红外光谱分析其中只含C-H键和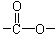 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
_______________。
(2)写出实验室制备A的化学方程式_________________________________________。
Ⅱ.苯甲酸甲酯(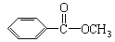 )是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠(
)是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯。已知:
)]、甲醇为原料制备苯甲酸甲酯。已知:
| 熔点 ℃ | 沸点 ℃ | 水溶性 |
甲醇 | —97.8 | 64.7 | 易溶 |
苯甲酸(一元弱酸) | 122.4 | 249.3 | 常温:0.17g;100℃:6.8g |
苯甲酸甲酯 | —12.3 | 198 | 难溶 |
合成苯甲酸甲酯的流程如下:

请回答下列问题:
(1)温度①约为_________℃,操作③为_________,操作④为__________。
(2)第②步加热的目的是______________________________________。
(3)选择合适的制备苯甲酸甲酯的装置:______________。
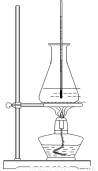
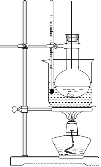
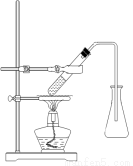
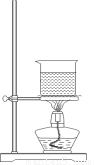
A B C D
(4)苯甲酸甲酯有多种同分异构体,写出符合下列条件的任意一种同分异构体的结构简式_______。①为芳香化合物 ②含有醛基 ③能与金属Na反应