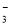题目内容
汽车等机动车辆的启动电源常用铅蓄电池,放电时的电池反应如下:
PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
A.Pb02是电池的负极
B.负极的电极反应式为:Pb+SO42--2e-=PbSO4
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
B
【解析】
试题分析:A.根据电池反应式知,二氧化铅得电子发生还原反应,所以二氧化铅是正极,故A错误;B.负极上铅失电子和硫酸根离子反应生成硫酸铅,电极反应式为:Pb(s)+SO42-(aq)-2e-=PbSO4(s),故B正确;C.二氧化铅得电子被还原,故C错误;D.电池放电时,硫酸参加反应生成水,所以溶质的质量减少,溶剂的质量增加,所以溶液酸性减弱,故D错误;
考点:二次电池的有关知识

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目