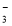题目内容
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③2.0molPCl3和1.0molCl2充入恒容的密闭容器中,发生反应:PCl3(g)+ Cl2(g) PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡不会发生移动
A.①④ B.①②③ C.②③④ D.①②③④
D
【解析】
试题分析:①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),碳是固体,增加碳的量,平衡不移动,错误;②已达平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),碳是固体,增加碳的量,平衡不移动,错误;②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率降低,提高的是氢气的转化率;③2.0molPCl3和1.0molCl2充入恒容的密闭容器中,发生反应:PCl3(g)+ Cl2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率降低,提高的是氢气的转化率;③2.0molPCl3和1.0molCl2充入恒容的密闭容器中,发生反应:PCl3(g)+ Cl2(g) PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,相当于减压,平衡向左移动,在相同温度下再达平衡时PCl5的物质的量应小于0.20mol,错误;④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,压强不变,体积增加,浓度变化,对于方程式左右两边计量系数不等的方程,平衡将会发生移动,错误。因此答案选D。
PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,相当于减压,平衡向左移动,在相同温度下再达平衡时PCl5的物质的量应小于0.20mol,错误;④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,压强不变,体积增加,浓度变化,对于方程式左右两边计量系数不等的方程,平衡将会发生移动,错误。因此答案选D。
考点:考查化学反应平衡移动原理

 轻松暑假总复习系列答案
轻松暑假总复习系列答案