题目内容
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 向酸性高锰酸钾溶液中通入SO2 | 溶液颜色褪去 | SO2具有漂白性 |
B | 将少量铜粉加入FeCl3溶液中 | 铜粉消失 | 还原性:Cu>Fe2+ |
C | 向溶液X中先滴加稀硝酸,再滴加氯化钡溶液 | 有白色沉淀生成 | 溶液X中含有SO |
D | 锌与稀硫酸反应制取氢气时,加入少量硫酸铜溶液 | 反应速率加快 | Cu2+起催化作用 |
A.AB.BC.CD.D
【答案】B
【解析】
A. 向酸性高锰酸钾溶液中通入SO2,颜色褪去是因为SO2被高锰酸钾氧化,说明SO2具有还原性,故A结论错误;
B. 将少量铜粉加入FeCl3溶液中,反应为2Fe3++Cu=Cu2++2Fe2+,Cu为还原剂,Fe2+为还原产物,还原剂的还原性强于还原产物的还原性,所以还原性:Cu>Fe2+,故B正确;
C. 因为硝酸具有强氧化性,若溶液中含有SO32-,则用硝酸酸化后加氯化钡溶液也有白色沉淀生成,故C结论错误;
D. 加入硫酸铜后,锌置换出铜,构成原电池,反应加快,故D结论错误;
故选B。

【题目】甲醇、二甲醚(CH3OCH3) 既是重要的化工原料,又是可再生能源,具有开发和应用广阔前景。
(1)合成二甲醚的反应原理为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
①该反应能够自发进行的原因是_______。
②若容器的体积恒定不变,CO、H2起始通入量分别为2 mol、4 mol,充分反应后达到平衡。下列措施既可以提高反应速率又可以提高CO的转化率是_______。
a.升高温度 b.使用更高效的催化剂
c.充入He,使体系总压强增大 d.缩小体积增大压强
(2)工业上合成甲醇的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-91 kJ·mol-1
CH3OH(g) ΔH=-91 kJ·mol-1
①已知某些化学键的键能数据如下表,则x=_______。
化学键 | C-H | H-H | C-O | C≡O | O-H |
键能/ kJ·mol-1 | a | b | c | x | d |
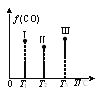
②在Ⅰ、Ⅱ、Ⅲ三个恒压容器中分别充入a mol CO和2a mol H2合成甲醇,三个容器的温度分别为T1、T2、T3。若实验测得反应均进行到t min时,三个容器中CO的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是_____。若反应达到平衡,三个容器中v(CH3OH)逆最大的是____。