题目内容
5.随着大气污染的日趋严重,国家拟于“十二五”期间将二氧化硫(SO2)排放减少8%,氢氧化物排放量减少10%.目前,消除大气污染有多重方法.I.处理NO2的一种方法是利用甲烷催化还原NO2.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ.mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ.mol
则△H2=-1160kJ•mol-1
Ⅱ.化石燃料的燃烧,含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源.
将煤转化为谁每期是将煤转化为结晶燃料的方法之一,反应为:C(s)+H2O(g)?CO(g)+H2(g)
一定温度下,在1.0L密闭容器中放入1molC(s)、1molH2O(g)进行反应,反应时间(t)与容器内气体总压强平(p)的数据见下表
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
(1)下列那些选项可以说明该可逆反应已达平衡状态AD
A.混合气体的密度不再发生改变
B.消耗1molH2O(g)的同时生成1molH2
C.△H不变
D.V正(CO)=V逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=$\frac{P}{{P}_{0}}$mol;由表中数据计算达到平衡时,反应物H2O(g)的转化率α=79.82%(精确到小数点后第二位)
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能值得氨气,具体流程如下:
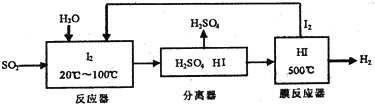
①用化学方程式表示整个过程发生的总反应SO2+2H2O=H2SO4+H2
②用化学平行移动的原理分析,在HI分解反应中使用膜反应器分离出H的目的是降低生成物的浓度,使平衡向正方向移动
Ⅲ.(1)将1.0molCH4和2.0molH2O(g)通入容积为100L的反应器,在一定条件下发生反应:
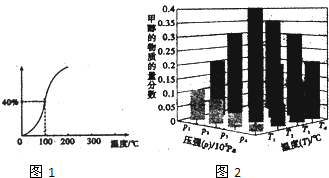
CH4(g)+H2O(g)?CO(g)+3H2(g)测得在一定的压强下CH4的平衡转换率于温度的关系如图1.100℃时该反应的平衡常数为7.2×10-5
(2)在一定温度和压强条件下发生了反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<O,反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图2所示,关于温度(T)和压强(P)的关系判断准确的是CD(填序号)
A.P3>P2,T3>T2 B.P2>P4,T4>T2 C.P1>P3,T1>T3 D.P1>P4,T1>T4
分析 I.根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也进行相应的计算;
Ⅱ.(1)可逆反应到达平衡时,同一物质的正逆反应速率相等,各组分的浓度、含量不变,由此衍生的一些其它量不变,该物理量应随反应进行发生变化,当该物理量由变化到不变化,说明到达平衡;
(2)恒温恒容下,压强之比对气体物质的量之比,据此计算反应体系的总物质的量;
由表中数据可知,20h与30h时总压强相等,故20h时反应到达平衡,根据压强与总物质的量关系计算此时n总,再结合方程式、利用差量法计算参加反应水的物质的量,进而计算水的转化率;
(3)①从流程图可知,在反应器中I2氧化SO2生成硫酸和HI,在膜反应器中HI分解为氢气与I2,碘循环利用,整个过程相当于二氧化硫与水反应生成硫酸与氢气;
②降低生成物的浓度,使平衡向正方向移动;
Ⅲ.(1)由图可知,平衡时甲烷的转化率为40%,据此计算参加反应甲烷物质的量,利用三段式计算平衡时各组分的物质的量,进而计算各组分的平衡浓度,代入平衡常数表达式K=$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$计算;
(2)对于反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,正反应为气体体积减小的吸热反应,增大压强,平衡向正反应方向移动,甲醇的物质的量分数则越大,升高温度,平衡向逆反应方向移动,甲醇的物质的量分数越小.
解答 解:Ⅰ.已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ.mol,
由盖斯定律,③×2-①得到:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),故△H2=(-867kJ•mol-1)×2-(-574kJ•mol-1)=-1160kJ•mol-1,
故答案为:-1160kJ•mol-1;
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
Ⅱ.(1)A.随反应进行,混合气体总质量增大,容器容积不变,混合气体密度增大,混合气体密度不变,说明到达平衡,故A正确;
B.消耗1molH2O(g)的同时生成1molH2,均表示正反应速率,二者反应速率始终相等,故B错误;
C.△H与是否到达平衡无关,与反应中各物质的化学计量数有关,故C错误;
D.若V正(CO)=V逆(H2),由速率之比等于其化学计量数之比,则V正(CO)=V逆(CO),故反应到达平衡,故D正确,
故选:AD;
(2)恒温恒容下,压强之比对气体物质的量之比,则P:P0=n总:1mol,故n总=$\frac{P}{{P}_{0}}$mol;
由表中数据可知,20h与30h时总压强相等,故20h时反应到达平衡,平衡时压强为8.2,
则n总=$\frac{8.2}{4.56}$mol,C(s)+H2O(g)?CO(g)+H2(g)物质的量增大
1 1
n(H2O) $\frac{8.2}{4.56}$mol-1mol=$\frac{3.64}{4.56}$mol,
故参加反应n(H2O)=$\frac{3.64}{4.56}$mol,水的转化率为$\frac{\frac{3.64}{4.56}mol}{1mol}$×100%=79.82%,
故答案为:$\frac{P}{{P}_{0}}$;79.82%;
(3)①从流程图可知,在反应器中I2氧化SO2生成硫酸和HI,在膜反应器中HI分解为氢气与I2,碘循环利用,整个过程相当于二氧化硫与水反应生成硫酸与氢气,总反应方程式为:SO2+2H2O=H2SO4+H2,
故答案为:SO2+2H2O=H2SO4+H2;
②分离出氢气,降低生成物的浓度,使平衡向正方向移动,
故答案为:降低生成物的浓度,使平衡向正方向移动;
Ⅲ.(1)由图可知,平衡时甲烷的转化率为40%,参加反应甲烷物质的量为1mol×40%=0.4mol,则:
CH4(g)+H2O(g)?CO(g)+3H2(g)
开始(mol):1 2 0 0
转化(mol):0.4 0.4 0.4 1.2
平衡(mol):0.6 1.6 0.4 1.2
则平衡常数表达式K=$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$=$\frac{\frac{0.4}{100}×(\frac{1.2}{100})^{3}}{\frac{0.6}{100}×\frac{1.6}{100}}$=7.2×10-5,
故答案为:7.2×10-5;
(2)对于反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,正反应为气体体积减小的吸热反应,增大压强,平衡向正反应方向移动,甲醇的物质的量分数则越大,升高温度,平衡向逆反应方向移动,甲醇的物质的量分数越小,
由图可知,一定温度下,压强为P1、P2、P3、P4,对应甲醇的质量分数依次增大,正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,甲醇的质量分数增大,故压强为P1>P2>P3>P4;
一定压强下,温度为T1、T2、T3、T4,对应甲醇的质量分数依次增大,正反应为放热反应,升高温度,平衡向逆反应方向移动,甲醇的质量分数减小,故温度为T1>T2>T3>T4,
故答案为:CD.
点评 本题属于拼合型题目,涉及反应热计算、化学平衡状态判断、化学工艺流程、化学平衡有关计算、化学平衡常数计算、化学平衡图象及影响因素等,需要学生具备扎实的基础,难度中等.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案| A. | 以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 其他条件不变时,若增大压强,则物质Y的转化率减小 | |
| D. | 其他条件不变时,若升高温度,X的体积分数增大,则该反应的△H>0 |
| 类 别 | 典型代表物名称 | 官能团名称 | 结构简式 |
| 醇 | 乙醇 | 羟基 | CH3CH2OH |
| 酚 | 苯酚 | 羟基 |  |
| 醛 | 乙醛 | 醛基 | CH3CHO |
| 羧酸 | 乙酸 | 羧基 | CH3COOH |
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3s的平均速率为v(NO2)=0.24mol•L-1•s-1 | |
| B. | 24s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2,反应达到平衡时,压强为起始的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0molN2O5和2.0molO2,达到平衡时,N2O5的转化率大于20% |
| A. | 试管 | B. | 烧杯 | C. | 量筒 | D. | 集气瓶 |

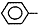 CH=CH2),聚苯乙烯的化学式为
CH=CH2),聚苯乙烯的化学式为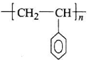 .
.