题目内容
16. 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是:先加入乙醇,然后沿着试管壁慢慢加入浓硫酸,冷却后再加乙酸,然后轻轻振荡试管,使之混合均匀.
(2)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是防止Na2CO3溶液的倒吸.造成倒吸的操作上的原因是加热不均匀.
(3)浓硫酸的作用是①催化剂; ②吸水剂.
(4)饱和Na2CO3溶液的作用是吸收乙醇;反应乙酸;减少酯的溶解,有利于分层.
(5)生成的乙酸乙酯的化学方程式CH3COOH+C2H5OH
 CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有果香味.
CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有果香味.(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是乙醚(填物质名称).
分析 (1)混合乙醇和浓硫酸的方法是先加入一定量的乙醇,然后边振荡边加入浓硫酸,防止酸液飞溅;
(2)防止由于加热不均匀造成Na2CO3溶液倒流进加热反应物的试管中,导致试管破裂;
(3)乙酸与乙醇在浓硫酸作催化剂加热条件下生成乙酸乙酯,由于反应为可逆反应,同时浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动;
(4)实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:除去乙酸和乙醇,并降低乙酸乙酯的溶解度,增大水的密度,使酯浮于水面,容易分层析出,便于分离;
(5)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,酯类的密度比水小,低级酯有香味;
(6)乙醇在140℃,在浓硫酸催化下生成乙醚.
解答 解:(1)为防止酸液飞溅,应将密度大的液体加入到密度小的液体中,第一步是防止液体飞溅,原理和浓H2SO4加入水中是一个道理.冷却后加乙酸是因为防止过热乙酸挥发,则操作为:先加入乙醇,然后沿着试管壁慢慢加入浓硫酸,冷却后再加乙酸;
故答案为:先加入乙醇,然后沿着试管壁慢慢加入浓硫酸,冷却后再加乙酸;
(2)加热不均匀易造成Na2CO3溶液倒流进加热反应物的试管中,导致试管破裂,故答案为:加热不均匀;
(3)乙酸与乙醇在浓硫酸作催化剂加热条件下生成乙酸乙酯,由于反应为可逆反应,同时浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动,
故答案为:催化剂;吸水剂;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质,
故答案为:吸收乙醇;反应乙酸;减少酯的溶解,有利于分层;
(5)因乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应:CH3COOH+C2H5OH CH3COOC2H5+H2O,乙酸乙酯密度小于水的密度,有香味,故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O,乙酸乙酯密度小于水的密度,有香味,故答案为:CH3COOH+C2H5OH CH3COOC2H5+H2O;小;果香;
CH3COOC2H5+H2O;小;果香;
(6)乙醇在140℃,在浓硫酸催化下脱水生成乙醚,故答案为:乙醚.
点评 本题考查乙酸乙酯的制备,题目难度不大.注意饱和碳酸钠溶液的作用以及反应液混合的顺序.

 阅读快车系列答案
阅读快车系列答案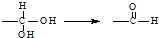 ,下列有关有机物
,下列有关有机物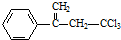 的说法不正确的是( )
的说法不正确的是( )| A. | 属于卤代烃,能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | 该物质存在顺反异构 | |
| C. | 在碱性条件下充分水解,可生成羧酸盐 | |
| D. | 1mol 该物质在一定条件下可与4molH2发生加成反应 |
 已知H2O2分子的结构如图所示,此分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,试推测H2O2可能具有的性质是( )
已知H2O2分子的结构如图所示,此分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,试推测H2O2可能具有的性质是( )| A. | H2O2分子为非极性分子 | B. | H2O2易溶于CS2 | ||
| C. | H2O2分子中只含σ键 | D. | H2O2分子中只含极性键 |
| A. | 18和12 | B. | 6和8 | C. | 11和16 | D. | 12和9 |
| 族 周期 | ⅠA | 0 | ||||||
| ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 2He | ||
| 1 | A | |||||||
| 2 | B | C | D | |||||
| 3 | E | F | G | H | I | J | K | L |
(2)下列有关元素性质的递变规律正确的是C
A、氢氧化物的碱性E<F<G
B、获得电子的能力I>J>K
C、气态氢化物的稳定性D>K
D、原子半径H<I<J<K.
| A. | 溴和汞的气化 | B. | 二氧化硅和C60的熔化 | ||
| C. | 氯化氢和氯化钠的溶解 | D. | 碘和干冰的升华 |
| A. | 单位时间消耗nmol A,同时生成2nmolC | |
| B. | A,B,C的分子数之比为1:2:3 | |
| C. | A,B,C的浓度相等 | |
| D. | 生成C的速率与分解C的速率相等 |
 按以下步骤从
按以下步骤从 合成
合成  .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去) 、D
、D .
.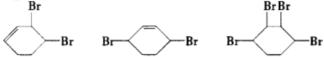 ;
;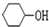 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$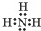 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.