题目内容
【题目】电离平衡常数(Ka、Kb)、水的离子积常数(Kw)、盐的水解常数(Kh)是电解质溶液中的三大常数,学习中我们要注意他们的区别与联系,通过学习的相关知识请完成以下练习。
(1)已知:a.常温下,醋酸和NH3H2O的电离常数相同。
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O
①CH3COONH4溶液呈_______性(填"酸"、"碱"或"中",下同)。
②NH4HCO3溶液呈________性,溶液中物质的量浓度最大的离子是______(填化学式)。
(2)室温时,若用盐酸滴定氨水,当滴定过程中pH=9时,且溶液中满足4c(NH4+)=7c(NH3·H2O),则氨水的电离平衡常数Kb(NH3·H2O)=____________(填数值)。
(3)100℃时,Kw=1.0×10-12,该温度下测得0.1mol/L Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为__________________________________
②该温度下,将0.01mol/L H2A 溶液稀释20倍后,溶液的pH=__________
(4)已知常温下CN-的水解常数Kh=1.61×10-5。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显______(填“酸”、“碱”或“中”)性,c(CN-)_____(填“>”、“<”或“=”)c(HCN)。
学法题:就以上的解答思考,电离平衡常数(Ka)、水的离子积常数(Kw)、盐的水解常数(Kh)之间有什么关系,请写出他们的关系式____________
【答案】中 碱 NH4+ 1.75×10—5 H2A = 2H+ + A2- 3 碱 < KaKh=Kw
【解析】
(1)判断盐溶液酸碱性时,注意比较阴、阳离子水解程度;溶液中物质的量浓度最大的离子为强电解质离子或水解程度较弱的离子。
(2)电离平衡常数![]() ,将4c(NH4+)=7c(NH3·H2O)和pH=9带入直接计算即可。
,将4c(NH4+)=7c(NH3·H2O)和pH=9带入直接计算即可。
(3)根据溶液pH判断离子是否为强电解质,强电解质电离方程书写“=”。
(4) KaKh=Kw,已知Kh可计算Ka值,进行后续比较。
(1).①已知常温下,醋酸和NH3H2O的电离常数相同,二者的电离程度相等,即CH3COO-和NH4+的水解程度相同,溶液呈中性。
②根据CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O可知,醋酸酸性比碳酸强,即醋酸的电离程度大于碳酸;由已知可知,醋酸和NH3H2O的电离常数相同,即NH3H2O电离常数大于碳酸,碳酸氢根的水解程度比铵根的水解程度大,即NH4HCO3溶液呈碱性,溶液中物质的量浓度最大的离子是NH4+。
(2)室温时,若用盐酸滴定氨水,当pH=9时,溶液为NH4Cl和NH3·H2O混合, c(OH-)=10-5mol/L,溶液中满足4c(NH4+)=7c(NH3·H2O),则氨水的电离平衡常数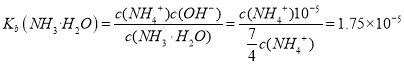 。
。
(3)100℃时,Kw=1.0×10-12,该温度下Na2A溶液的pH=6呈中性,说明H2A为强酸,完全电离。
①H2A在水溶液中的电离方程式为H2A = 2H+ + A2-;
②该温度下,0.01mol/L H2A 溶液中c(H+)=0.02mol/L,稀释20倍后,c(H+)=0.001mol/L,溶液的pH=-lgc(H+)=3;
(4)常温下,HCN的电离常数![]() ,CN-的水解常数
,CN-的水解常数![]() ,
,![]() ,则当Kh=1.61×10-5时,Ka=6.2×10-10,即CN-的水解程度大于HCN的电离程度。由于盐和酸的浓度相同,故水解产生的氢氧根离子大于电离产生的氢离子,溶液显碱性,c(CN-)<c(HCN)。
,则当Kh=1.61×10-5时,Ka=6.2×10-10,即CN-的水解程度大于HCN的电离程度。由于盐和酸的浓度相同,故水解产生的氢氧根离子大于电离产生的氢离子,溶液显碱性,c(CN-)<c(HCN)。

 发散思维新课堂系列答案
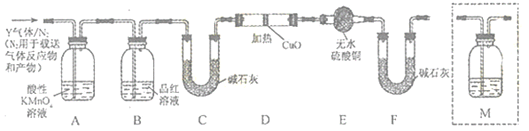
发散思维新课堂系列答案【题目】如图是某同学研究铜与浓硫酸的反应装置:
完成下列填空:
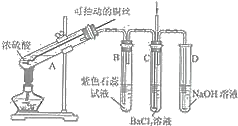
(1)写出A中发生反应的化学方程式______,采用可抽动铜丝进行实验的优点是______。
(2)反应一段时间后,可观察到B试管中的现象为______。
(3)从C试管的直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是______、______.(要求填一种化合物和一种单质的化学式)。
(4)反应完毕,将A中的混合物倒入水中,得到呈酸性的蓝色溶液与少量黑色不溶物,分离出该不溶物的操作是______,该黑色不溶物不可能是CuO,理由是______。
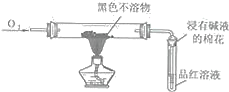
(5)对铜与浓硫酸反应产生的黑色不溶物进行探究,实验装置及现象如下:
实验装置 | 实验现象 |
| 品红褪色 |
①根据实验现象可判断黑色不溶物中一定含有______元素。
②若该黑色不溶物由两种元素组成且在反应前后质量保持不变,推测其化学式为______。