题目内容
【题目】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。
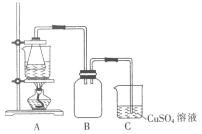
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol·L-1的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________________。
(2)装置C的作用是__________________________。
(3)步骤④中洗涤时所用的洗涤剂最好是______(填标号)。
A.稀硝酸 B.无水乙醇 C.苯
(4)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用cmol·L-1的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
蒸馏水煮沸的原因:______________;产品的纯度为_________________(列出计算表达式即可)
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
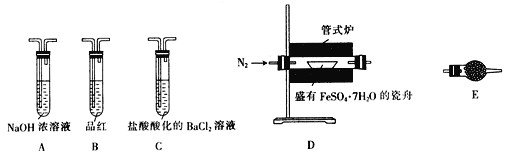
操作步骤 | 实验现象 | 解释原因 |
组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
气体产物经过试管B时 | 品红溶液褪色 | (5)产物中含有___________。 |
气体产物经过试管C时 | 试管C中出现白色沉淀 | (6)C中反应的化学方程式为________________________。 |
将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (7)_________________。 | (8)溶液中中含有__________。 |
(9)依据实验现象及产物,写出FeSO4·7H2O分解的化学方程式:_________________。
【答案】保证溶液中都是Fe2+ 除去H2S、PH3等杂质 B 除去蒸馏水中的氧气 ![]() 产物中有二氧化硫 SO3+H2O+BaCl2===BaSO4↓+2HCl 溶液变成血红色 溶液含有Fe3+ 2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O
产物中有二氧化硫 SO3+H2O+BaCl2===BaSO4↓+2HCl 溶液变成血红色 溶液含有Fe3+ 2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O
【解析】
I.(1)步骤②中需控制硫酸的用量,使铁粉过量,保证溶液中不含Fe3+;
(2) 铁屑中含有少量FeS、Fe3P等,与稀硫酸反应产生H2S、PH3等污染性气体;
(3) A.稀硝酸能氧化亚铁离子;B.无水乙醇能同时带走FeSO4·7H2O表面的水;
C.苯与水不溶,不适合作洗涤剂;
(4) 配制硫酸亚铁溶液所用的蒸馏水应预先煮沸,以除去溶解在水中的氧气;滴定过程中KMnO4将Fe2+氧化为Fe3+,发生反应的离子方程式为MnO4-+5 Fe2++8H+=Mn2++5 Fe3++4H2O,根据反应关系求出产品纯度;
Ⅱ.(5)气体产物经过试管B时,分解得到的产物中含SO2,品红溶液褪色;
(6)气体产物经过试管C时,与氯化钡溶液反应生成白色沉淀;
(7)将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液,溶液变红;
(8)因为产物中含有SO2,S元素化合价降低则Fe元素化合价会升高,溶于足量稀硫酸后溶液含有Fe3+;
(9)依据实验现象知产物为Fe2O3、SO2、SO3和H2O,据此可写出FeSO4·7H2O分解的化学方程式。
I.(1)步骤②中需控制硫酸的用量,使铁粉过量,保证溶液中不含Fe3+;
故答案为:保证溶液中都是Fe2+;
(2) 铁屑中含有少量FeS、Fe3P等,与稀硫酸反应产生H2S、PH3等污染性气体,故装置C的作用是除去H2S、PH3等杂质;
故答案为:除去H2S、PH3等杂质;
(3) A.稀硝酸能氧化亚铁离子,选项A不选;
B.无水乙醇能同时带走FeSO4·7H2O表面的水,选项B选;
C.苯与水不溶,不适合作洗涤剂,选项C不选;
故答案为:B;
(4) 配制硫酸亚铁溶液所用的蒸馏水应预先煮沸,以除去溶解在水中的氧气;滴定过程中KMnO4将Fe2+氧化为Fe3+,发生反应的离子方程式为MnO4-+5 Fe2++8H+=Mn2++5 Fe3++4H2O,根据反应关系,产品纯度为![]() ;
;
故答案为:除去蒸馏水中的氧气;![]() ;
;
Ⅱ.(5)气体产物经过试管B时,分解得到的产物中含SO2,品红溶液褪色;
故答案为:产物中有二氧化硫;
(6)气体产物经过试管C时,与氯化钡溶液反应生成白色沉淀,C中反应的化学方程式为SO3+H2O+BaCl2===BaSO4↓+2HCl;
故答案为:SO3+H2O+BaCl2===BaSO4↓+2HCl;
(7)将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液,溶液变红;
故答案为:溶液变成血红色;
(8)因为产物中含有SO2,S元素化合价降低则Fe元素化合价会升高,溶于足量稀硫酸后溶液含有Fe3+;
故答案为:溶液含有Fe3+;
(9)依据实验现象及产物,FeSO4·7H2O分解的化学方程式:2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O。
故答案为:2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】已知:H2(g)+I2(g)![]() 2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
起始浓度 | c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)(mol·L-1) |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25







