题目内容
【题目】下列状态的物质,既属于电解质又能导电的是( )
A. 氯化镁晶体 B. 氯化钠溶液
C. 液态氯化氢 D. 熔融氢氧化钾
【答案】D
【解析】
A. 氯化镁晶体是化合物,是电解质,晶体里没有自由移动的离子不导电,故A 错误;
B. 氯化钠溶液是混合物,不是电解质,故B错误;
C. 液态氯化氢是电解质,但不导电,故C错误;
D. 熔融氢氧化钾属于电解质,有自由移动的离子,能导电,故D正确;
故选D。

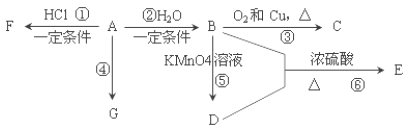
【题目】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
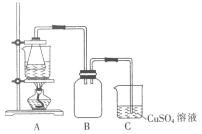
②将处理后的废铁屑放入锥形瓶中,加入适量3mol·L-1的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________________。
(2)装置C的作用是__________________________。
(3)步骤④中洗涤时所用的洗涤剂最好是______(填标号)。
A.稀硝酸 B.无水乙醇 C.苯
(4)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用cmol·L-1的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
蒸馏水煮沸的原因:______________;产品的纯度为_________________(列出计算表达式即可)
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
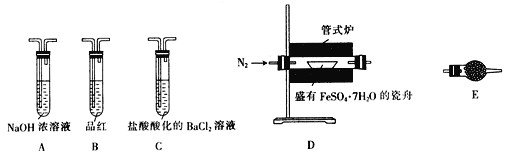
操作步骤 | 实验现象 | 解释原因 |
组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
气体产物经过试管B时 | 品红溶液褪色 | (5)产物中含有___________。 |
气体产物经过试管C时 | 试管C中出现白色沉淀 | (6)C中反应的化学方程式为________________________。 |
将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (7)_________________。 | (8)溶液中中含有__________。 |
(9)依据实验现象及产物,写出FeSO4·7H2O分解的化学方程式:_________________。
【题目】(1)用H2O2和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:Cu(s) +2H+(aq) =Cu2+(aq) +H2(g) △H=64kJ/mol;2H2O2(l)=2H2O(l)+O2(g) △H= -196kJ/mol;H2(g)+1/2O2(g)=H2O(l) △H= -286kJ/mol.在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为___________。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温 度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率×10-3mol.L-1.min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______________。
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是_________________________。