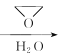
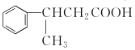题目内容
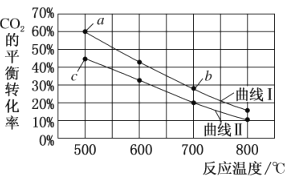
【题目】在恒容密闭容器中将CO2与含少量CO的H2混合生成甲醇,反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),下图表示按![]() 分别为①1:4和②1:6两种投料比时,CO2的平衡经随温度变化的曲线。
分别为①1:4和②1:6两种投料比时,CO2的平衡经随温度变化的曲线。
设①②两种投料比时CO2投料的物质的量浓度相等。下列有关说法正确的是
A.按投料比①时,CO2的平衡转化率随温度变化的曲线对应的是图中的曲线l
B.图中a点对应的H2的转化率为30%
C.图中b点对应的平衡常数K的值大于c点
D.![]() 的数值,a点比c点小
的数值,a点比c点小
【答案】D
【解析】
A.①②两种投料比时CO2投料的物质的量浓度相等,则投料比越小,即c(H+)+c(CO)越大,氢气的浓度增大,平衡正向移动,CO2的转化率增大,所以曲线I为投料比②时的曲线,曲线II为投料比①时的曲线,故A错误;
B.题目只给了![]() 的比值,混合气体中氢气的占比未知,所以无法计算氢气的转化率,故B错误;
的比值,混合气体中氢气的占比未知,所以无法计算氢气的转化率,故B错误;
C.据图可知相同投料比的情况下,温度升高CO2的平衡转化率减小,平衡逆向移动,所以该反应为放热反应,温度越高平衡常数越小,b点温度高于c点,所以b点对应的平衡常数K的值小于c点,故C错误;
D.曲线I为投料比②时的曲线,曲线II为投料比①时的曲线,容器恒容,CO不参与反应,虽然H2和CO混合气体中各组分的占比未知,但各组分占比不变,所以![]() ,设初始ca(CO2)=1mol/L,a点转化率为60%,结合化学方程式可知平衡时ca(CO2)=0.4mol/L,ca(CH3OH)=0.6mol/L,则
,设初始ca(CO2)=1mol/L,a点转化率为60%,结合化学方程式可知平衡时ca(CO2)=0.4mol/L,ca(CH3OH)=0.6mol/L,则![]() ,c点转化率约为45%,同理可得
,c点转化率约为45%,同理可得![]() ,则
,则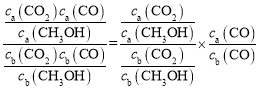 =
=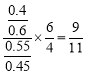 <1,所以
<1,所以![]() 的数值,a点比c点小,故D正确;
的数值,a点比c点小,故D正确;
故答案为D。

 名师点拨卷系列答案
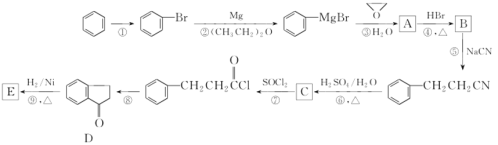
名师点拨卷系列答案【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
【题目】下列根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向溶有SO2的BaCl2溶液中通入气体X | 产生白色沉淀 | X一定是氧化性气体 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | 向Na2CO3溶液中加入冰醋酸,将产生的气体直接通入苯酚钠溶液中 | 产生白色浑浊 | 酸性:醋酸>碳酸>苯酚 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I3- |
A.AB.BC.CD.D