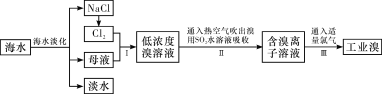
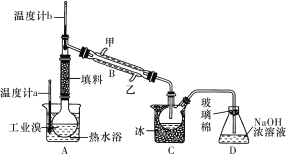
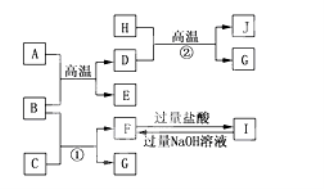
题目内容
【题目】某溶液中可能含有Fe2+ 、Mg2+、Cu2+、NH4+、Al3+。当加入1 种淡黄色固体并加热时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示。
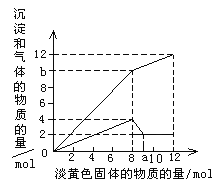
(1)淡黄色固体是__________________________。
(2)可知溶液中一定没有的离子是 ,理由是 。
(3)请解释为什么在投入8mol淡黄色固体后,产生气体的量在减少 。
(4)写出淡黄色固体加入的量为8mol到10mol之间发生的所有离子方程式 。
(5)所含离子的物质的量之比为__________________________。
【答案】(1)Na2O2
(2)Fe2+,Cu2+;只产生白色沉淀,Cu(OH)2是蓝色沉淀,Fe2+被Na2O2氧化为Fe3+,将会产生红褐色沉淀。
(3)8mol之后,NH4+ 被消耗完全,产生的气体只有O2。
(4)2Na2O2+2H2O=4 Na++4OH-+O2↑,Al(OH)3+OH-=AlO2-+2H2O
(5)1:1:3 (顺序可调换)
【解析】
试题分析:(1)淡黄色固体为Na2O2,故答案为:Na2O2;
(2)淡黄色粉末是过氧化钠,加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,当加入过量的过氧化钠时,生成白色沉淀,Cu(OH)2是蓝色沉淀,Fe2+被Na2O2氧化为Fe3+,将会产生红褐色沉淀。因此无Fe2+, Cu2+,通过图象知,在加入过量的过氧化钠的过程中,沉淀部分溶解,推断一定含有Al3+ 和Mg2+,氢氧化镁不溶于强碱,氢氧化铝是两性氢氧化物,可以溶于强碱,最终的白色沉淀的成分是氢氧化镁。溶液中一定没有的离子是Fe2+, Cu2+,理由是只产生白色沉淀,Cu(OH)2是蓝色沉淀,Fe2+被Na2O2氧化为Fe3+,将会产生红褐色沉淀,故答案为:Fe2+, Cu2+;只产生白色沉淀,Cu(OH)2是蓝色沉淀,Fe2+被Na2O2氧化为Fe3+,将会产生红褐色沉淀;
(3)在投入8mol淡黄色固体后,NH4+ 被消耗完全,产生的气体只有O2,产生气体的量逐渐减少,故答案为:NH4+ 被消耗完全,产生的气体只有O2;
(4)过氧化钠的量为8mol到10mol之间发生时过氧化钠与水反应放出氧气,同时生成氢氧化钠,生成的氢氧化钠溶解氢氧化铝,使得沉淀逐渐减少,反应的离子方程式为2Na2O2+2H2O=4 Na++4OH-+O2↑,Al(OH)3+OH-=AlO2-+2H2O,故答案为:2Na2O2+2H2O=4 Na++4OH-+O2↑,Al(OH)3+OH-=AlO2-+2H2O;
(5)根据a-12mol这一段,所得氢氧化镁的物质的量是2mol,所以含有镁离子其物质的量为2mol,消耗氢氧化钠4mol,即在0-8mol这一段内,共生成沉淀4mol,所以另外2mol是氢氧化铝,即铝离子的物质的量为2mol,12mol过氧化钠放出氧气6mol,根据图像,共生成气体12mol,因此铵离子与氢氧化钠的氢氧根反应生成氨气,生成6mol的氨气,所以含有铵根离子是6mol,Mg2+、Al3+、NH4+的物质的量之比为1:1:3,故答案为:1:1:3。

【题目】下列物质的描述和相关知识均正确的是( )
物质及变化 | 描述 | 相关知识 | |
A | 碘化钾溶液滴到土豆片上 | 变蓝色 | 土豆片含淀粉 |
B | 煤的气化 | 化学变化 | 主要反应是碳与水生成水煤气等 |
C | 乙烯和苯 | 都能使溴水褪色 | 分子中含有相同的碳碳双键 |
D | 蔗糖和麦芽糖 | 多糖 | 二者互为同分异构体 |