题目内容
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为 。
(2)由A、B、W三种元素组成的18电子微粒的电子式为 。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方式 。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种氯化物DA,熔点为800℃DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是__ (标准状况下)。
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为 。
【答案】(1)第三周期,IIIA族;(2)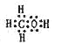 ;(3)H2O2
;(3)H2O2![]() H++HO2-;BaO2+H2SO4=BaSO4↓+H2O2;(4)Cu+ H++H2O2=Cu2++2H2O;(5)56L;(6)3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+。
H++HO2-;BaO2+H2SO4=BaSO4↓+H2O2;(4)Cu+ H++H2O2=Cu2++2H2O;(5)56L;(6)3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+。
【解析】试题分析:元素推断:A、B、W、D、E为短周期元素,且原子序数依次增大,且A、W能形成两种液态化合物A2W和A2W2知A为H,W为O;进而可知D为Na;E元素的周期序数与主族序数相等,可知为Al;再由五元素质子数之和为39得知B为C元素;(2)由A、B、W三种元素组成的18电子微粒:即H、C、O,三者电子数分别为1、6、8,加起来为15,只能再加三个氢原子,即18电子微粒应该为CH4O,也就是甲醇。电子式为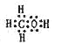 。(3)H2O2第一步电离方程式为:H2O2
。(3)H2O2第一步电离方程式为:H2O2![]() H++HO2-,依据强酸制弱酸,可知:BaO2+H2SO4=BaSO4↓+H2O2;(4)Cu在酸性环境中与O2反应的离子方程式为:Cu+ H++H2O2=Cu2++2H2O;(5)由: 2Na +H2=2NaH; NaH + H2O =" NaOH" + H2↑; 2Al+2NaOH+2H2O =2NaAlO2+3H2↑,知:2Al+2NaH+4H2O =2NaAlO2+5H2↑即可生成2.5molH2,也就是56L;(6)2Na2O2+2H2O=4Na++4OH—+ O2↑,4Fe2+ +O2+2H2O=4Fe3++4OH—,两式相加:2Na2O2+4Fe2+ +4H2O=4Na++8OH—+ 4Fe3+,上式右边OH—应该全部生成Fe(OH)3↓:Fe3++3OH—= Fe(OH)3↓,2Na2O2+4Fe2+ +4H2O=4Na++8/3Fe(OH)3↓ + 4/3Fe3+,两边再乘3/2即:3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+。
H++HO2-,依据强酸制弱酸,可知:BaO2+H2SO4=BaSO4↓+H2O2;(4)Cu在酸性环境中与O2反应的离子方程式为:Cu+ H++H2O2=Cu2++2H2O;(5)由: 2Na +H2=2NaH; NaH + H2O =" NaOH" + H2↑; 2Al+2NaOH+2H2O =2NaAlO2+3H2↑,知:2Al+2NaH+4H2O =2NaAlO2+5H2↑即可生成2.5molH2,也就是56L;(6)2Na2O2+2H2O=4Na++4OH—+ O2↑,4Fe2+ +O2+2H2O=4Fe3++4OH—,两式相加:2Na2O2+4Fe2+ +4H2O=4Na++8OH—+ 4Fe3+,上式右边OH—应该全部生成Fe(OH)3↓:Fe3++3OH—= Fe(OH)3↓,2Na2O2+4Fe2+ +4H2O=4Na++8/3Fe(OH)3↓ + 4/3Fe3+,两边再乘3/2即:3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+。