题目内容
下列实验方案不能达到预期目的的是( )
| A.用钠、镁分别与水反应,可证明钠、镁的金属性强弱 |
| B.用氯化镁、氯化铝分别于浓氨水反应,可证明钠、镁的金属性强弱 |
| C.用铁、石墨与硫酸铜溶液组成的原电池,可证明铁、铜的金属性强弱 |
| D.把氯气通入溴化钠的水溶液中,看到溶液呈橙色,可证明氯、溴的非金属性强弱 |
B
解析试题分析:A.比较元素金属性的强弱,可以用金属单质与水或酸发生反应置换出氢气的难易。用钠、镁分别与水反应,可证明钠、镁的金属性强弱。正确。B.用氯化镁、氯化铝分别于浓氨水反应,都能产生难溶性的金属氢氧化物沉淀,因此不可证明钠、镁的金属性强弱。应该改为强碱NaOH溶液。错误。C.一般情况下,活动性不同的金属在原电池反应中,活动性强的金属作负极,活动性弱的金属作正极。活动性强的可以把活动性弱的金属置换出来。所以用铁、石墨与硫酸铜溶液组成的原电池,可证明铁、铜的金属性强弱。正确。D.一般情况下,活动性强的非金属单质能把活动性弱的非金属单质从化合物的水溶液中置换出来。把氯气通入溴化钠的水溶液中,看到溶液呈橙色,可证明氯、溴的非金属性强弱。正确。
考点:考查元素的金属性、非金属性强弱的比较的知识。

 阅读快车系列答案
阅读快车系列答案卤素间形成的化合物如“IF5、BrCl、IBr”等称为卤素互化物,化学性质与卤素单质类似,则下列关于卤素互化物的性质的描述及发生的相关反应不正确的是( )
| A.IF5 + 3H2O = HIO3 +5HF |
| B.3IBr +2Fe = FeI3 + FeBr3 |
| C.BrCl的氧化性强于I2 |
| D.IBr可以与NaOH溶液反应生成2种盐 |
下表中对应关系正确的是
| A | CH3CH3+Cl2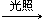 CH3CH2Cl+HCl CH3CH2Cl+HClCH2=CH2+HCl  CH3CH2Cl CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油 由淀粉得到葡萄糖 | 均发生了水解反应 |
| C | Cl2+2Br?=2Cl?+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O+4NaOH+O2↑ Cl2+H2O="HCl+HClO" | 均为水作还原剂的氧化还原反应 |
在一定条件下,RO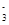 与R-可发生反应:RO
与R-可发生反应:RO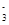 +5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A.元素R位于周期表中第ⅤA族 |
B.RO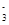 中的R只能被还原 中的R只能被还原 |
C.若1mol RO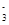 参与该反应,则转移的电子的物质的量为5mol 参与该反应,则转移的电子的物质的量为5mol |
| D.R2在常温常压下一定是气体 |
甲、乙代表2种金属,下列叙述中,不能判断金属活动性甲比乙强的是
| A.常温下,甲能从水中置换出氢,而乙不能 |
| B.最高价氧化物对应的水化物碱性比较,甲比乙的强 |
| C.甲与非金属反应时失电子比乙少 |
| D.甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡 |
下列进行性质比较的实验,不合理的是
| A.比较Cu、Fe的还原性:铜加入硫酸铁溶液中 |
| B.比较氯的非金属性强于溴:溴化钠溶液中通入氯气 |
| C.比较高锰酸钾的氧化性强于氯气:高锰酸钾中加入浓盐酸 |
| D.比较镁的金属性强于铝:取一小段去氧化膜的镁带和铝片,分别加入1.0 mol·L-1的盐酸中 |
Na2FeO4是一种高效多功能水处理剂,既能消毒杀菌,又能除去悬浮物杂质。一种制备Na2FeO4的反应原理为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列有关说法正确的是 ( )
| A.反应中氧化剂是Na2O2,还原剂是FeSO4 |
| B.生成2 mol Na2FeO4时,反应中共有8 mol电子转移 |
| C.Na2FeO4的氧化性大于Na2O2 |
| D.Na2FeO4净水过程中,既有氧化还原反应发生,又有非氧化还原反应发生 |
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是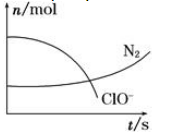
| A.还原剂是含CN-的物质,氧化产物只有N2 |
| B.氧化剂是ClO- , 还原产物是HCO3- |
| C.配平后氧化剂与还原剂的化学计量数之比为5∶2 |
| D.若生成2.24 L N2(标准状况),则转移电子0.5 mol |
已知:①Na3N+3H2O=3NaOH+NH3↑,②NaH+H2O=NaOH+H2↑。下列叙述正确的是
| A.离子半径:Na+>N3->H+ |
| B.反应①和②都是氧化还原反应 |
| C.反应②每生成1 mol H2,转移的电子数为NA |
| D.Na3N和NaH与盐酸反应都只生成一种盐 |