题目内容
在一定条件下,RO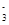 与R-可发生反应:RO
与R-可发生反应:RO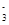 +5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A.元素R位于周期表中第ⅤA族 |
B.RO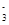 中的R只能被还原 中的R只能被还原 |
C.若1mol RO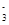 参与该反应,则转移的电子的物质的量为5mol 参与该反应,则转移的电子的物质的量为5mol |
| D.R2在常温常压下一定是气体 |
C
解析试题分析:A、从反应的离子方程式中可看出,R的最低价态是-1价,所以R是第七主族元素,错误;B、R是第七主族元素,则R的最高价是+7价,而RO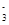 中的R是+5价,处于中间价态,既能被氧化也能被还原,错误;C、该反应中RO
中的R是+5价,处于中间价态,既能被氧化也能被还原,错误;C、该反应中RO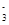 中的+5价R元素降为0价,所以若1mol RO
中的+5价R元素降为0价,所以若1mol RO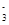 参与该反应,则转移的电子的物质的量为5mol,正确;D、第七主族元素不全是气体,错误,答案选C。
参与该反应,则转移的电子的物质的量为5mol,正确;D、第七主族元素不全是气体,错误,答案选C。
考点:考查元素位置的判断,氧化还原反应理论的应用

练习册系列答案
相关题目
下面有关氧化还原反应的叙述不正确的是 ( )
| A.氧化还原反应的本质是电子的转移 |
| B.在氧化还原反应中,失去电子的物质,一定有元素化合价升高 |
| C.肯定有一种元素被氧化,另一种元素被还原 |
| D.在反应中不一定所有元素的化合价都发生变化 |
关于反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O的有关叙述中,正确的是
| A.KCl中含有35Cl |
| B.生成物Cl2的相对分子质量为73.3 |
| C.该反应转移的电子数为6e- |
| D.氧化剂和还原剂的物质的量之比为1:6 |
下列实验方案不能达到预期目的的是( )
| A.用钠、镁分别与水反应,可证明钠、镁的金属性强弱 |
| B.用氯化镁、氯化铝分别于浓氨水反应,可证明钠、镁的金属性强弱 |
| C.用铁、石墨与硫酸铜溶液组成的原电池,可证明铁、铜的金属性强弱 |
| D.把氯气通入溴化钠的水溶液中,看到溶液呈橙色,可证明氯、溴的非金属性强弱 |
下列实验对应的结论正确的是:
| | A | B | C | D |
| 装 置 | 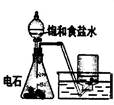 | 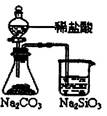 | 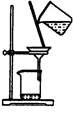 | 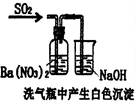 |
| 结 论 | 实验室制取乙炔 | 能证明非金属性 Cl>C>Si | 分离出Cl2与KI溶 液反应生成的碘 | 白色沉淀是BaSO3 |
高温下焙烧CuFeS2的反应之一为2CuFeS2+7O2=CuSO4+CuO+Fe2O3+3SO2,下列关于该反应的叙述正确的是
| A.CuFeS2中硫的化合价为-1 |
| B.CuFeS2发生还原反应 |
| C.1 mol CuFeS2完全反应转移13 mol电子 |
| D.CuSO4和SO2既是氧化产物,又是还原产物 |
容器中发生一个化学反应,反应过程中存在H2O、H2S、S、NH4+、H+、NO3—六种物质。在反应过程中测得NO3—和S的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是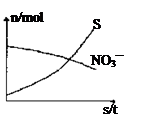
| A.配平后氧化剂与还原剂的化学计量数之比为1:4 |
| B.硫元素在反应中被还原 |
| C.还原剂是含NH4+的物质 |
| D.若生成1molNH4+,则转移电子2mol。 |
新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示,下列有关该转化过程的叙述正确的是( )
| A.MFe2O4表现了还原性 |
| B.MFe2Ox表现了还原性 |
| C.SO2和NO2表现了还原性 |
| D.SO2和NO2发生了分解反应 |
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是
| A.滴加KI溶液时,KI被氧化,CuI是氧化产物 |
| B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| C.通入22.4 L SO2参加反应时,有2NA个电子发生转移 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |