题目内容
11.有A,B,C,D,E五种短周期元素,A与B可形成BA型化合物,且A元素是非金属性最强的元素.金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个;C元素有三种同位素C1,C2,C3,自然界里含最多的是C1,C3的质量数是C1的3倍,C2的原子的质量数是C1的2倍.D的气态氢化物的水溶液呈碱性,而其最高价氧化物的水化物为强酸,E元素原子的最外层电子数比次外层电子数多4个,E离子的核外电子数比质子数多2个.(1)写出元素名称:A.氟 B.钠 C.氢 D.氮 E.硫.
(2)写出C1,C2,C3粒子的符号:11H,12H,13H
(3)写出E离子的结构示意图
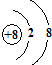 E的氢化物的分子式H2O.
E的氢化物的分子式H2O.(4)写出A的单质与B的单质反应的化学方程式F2+2Na=2NaF;
(5)写出A的单质和B的单质分别与水反应的化学方程式2F2+2H2O=4HF+O2,2Na+2H2O=4NaOH+O2↑,将二者反应后生成的溶液混合,发生反应的离子方程式为HF+OH-=F-+H2O
(6)A与C形成的化合物中含化学键类型是共价键,用电子式表示该化合物的形成过程
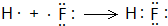 .
.
分析 A、B、C、D、E五种短周期元素,A是非金属性最强的元素,故A为F元素;D的气态氢化物的水溶液呈碱性,而其最高价氧化物的水化物为强酸,则D为N元素;E元素原子的最外层电子数比次外层电子数多4个,原子只能有2个电子层,最外层电子数为6,故E为O元素;C元素有三种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍,故C是H元素;A与B可形成BA型化合物,则B表现+1价,处于IA族,金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个,则B为Na,据此解答.
解答 解:(1)A、B、C、D、E五种短周期元素,A是非金属性最强的元素,故A为F元素;D的气态氢化物的水溶液呈碱性,而其最高价氧化物的水化物为强酸,则D为N元素;E元素原子的最外层电子数比次外层电子数多4个,原子只能有2个电子层,最外层电子数为6,故E为O元素;C元素有三种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍,故C是H元素;A与B可形成BA型化合物,则B表现+1价,处于IA族,金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个,则B为Na,
故答案为:氟;钠;氢;氮;硫;
(2)C为H元素,则C1、C2、C3三种原子分别为氢元素的三种核素:11H、12H、13H,故答案为:11H;12H;13H;
(3)E为O元素,E2-离子为氧离子,核电荷数为8,最外层达到8电子稳定结构,其离子结构示意图为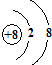 ,其氢化物为H2O,
,其氢化物为H2O,
故答案为: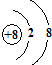 ;H2O;
;H2O;
(4)氟气与Na单质反应的化学方程式:F2+2Na=2NaF,故答案为:F2+2Na=2NaF;
(5)氟气与反应反应方程式为:2F2+2H2O=4HF+O2,Na与水反应方程式为:2Na+2H2O=4NaOH+O2↑,将反应后生成的溶液混合,发生反应的离子方程式为:HF+OH-=F-+H2O,
故答案为:2F2+2H2O=4HF+O2;2Na+2H2O=4NaOH+O2↑;HF+OH-=F-+H2O;
(6)A与C形成的化合物为HF,含有共价键,用电子式表示该化合物的形成过程: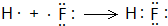 ,
,
故答案为:共价键;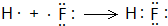 .
.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,难度不大.

| A. | 向Fe(NO3)3 溶液中滴入少量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 向AlCl3 溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Cu(OH)2沉淀溶于氨水得到深蓝色溶液:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O | |
| D. | 澄清石灰水中加入少量NaHCO3 溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
| A. | 标准状况下,2.24LSO3含有的分子数等于0.1NA | |
| B. | 1 mol Na2O2所含阴离子数为2NA | |
| C. | 常温常压下,16gO2 和O3的混合气体含有的氧原子数为NA | |
| D. | 常温常压和光照条件下,33.6 LCl2与3.0g H2反应,生成的HCl分子数目为3NA |
| A. | CH3OH | B. | (CH3)2CHOH | C. | (CH3)3COH | D. | (CH3)3CCH2OH |
| A. | HCI溶液的酸性比H2S溶液的酸性强 | |
| B. | 氯气能与硫化氢溶液反应:H2S+C12═2HCl+S↓ | |
| C. | 氯化氢比硫化氢稳定 | |
| D. | HClO4的酸性比H2SO4强 |
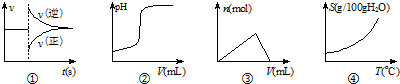
| A. | 曲线图①表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 曲线图②表示向一定量的硫酸溶液中滴加一定浓度的氢氧化钠溶液时pH的变化 | |
| C. | 曲线图③表示向一定量的NaAlO2溶液中滴加一定浓度的HCl溶液时的产生沉淀的物质的量变化 | |
| D. | 曲线图④可以表示所有的固体物质溶解度随温度的变化 |
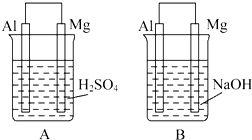 有A、B两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性质.分别设计如图所示的原电池,请完成以下问题:
有A、B两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性质.分别设计如图所示的原电池,请完成以下问题: