题目内容
2.设NA代表阿伏加德罗常数的数值.下列有关叙述正确的是( )| A. | 标准状况下,2.24LSO3含有的分子数等于0.1NA | |
| B. | 1 mol Na2O2所含阴离子数为2NA | |
| C. | 常温常压下,16gO2 和O3的混合气体含有的氧原子数为NA | |
| D. | 常温常压和光照条件下,33.6 LCl2与3.0g H2反应,生成的HCl分子数目为3NA |
分析 A、标况下,三氧化硫为固体;
B、过氧化钠由2个钠离子和1个过氧根构成;
C、氧气和臭氧均由氧原子构成;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、标况下,三氧化硫为固体,故不能根据其体积来计算其物质的量,故A产物;
B、过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含1mol阴离子即NA个,故B错误;
C、氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量n=$\frac{16g}{16g/mol}$=1mol,即NA个,故C正确;
D、常温常压下,气体摩尔体积大于22.4L/mol,故33.6L氯气的物质的量小于1.5mol,则生成的HCl分子个数小于3NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
12.现有部分元素的性质与原子(或分子)结构如表所示:
(1)写出元素T的原子结构示意图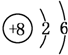 .
.
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式 .
.
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
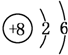 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式
 .
.
17.化学反应中通常伴随着能量变化,下列说法中错误的是( )
| A. | 煤燃烧时将化学能全部转化为热能 | |
| B. | 原电池将化学能转化为电能 | |
| C. | 二次电池充电时将电能转化为化学能 | |
| D. | 镁条燃烧时将部分化学能转化为光能 |
7.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).原子结构示意图为 .元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
.元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: .
.
(3)②的最高价氧化物的化学式为N2O5写出其最高价氧化物的水化物稀溶液与足量的铁粉反应的离子方程式3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)表示①与⑦、①与⑥形成的化合物的电子式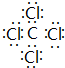 、
、 .
.
(6)③、⑥氢化物的沸点高低H2O的沸点高于H2S;原因H2O分子之间存在氢键
(7)④、⑥、⑦形成的简单离子的半径大小S2->Cl->Na+
(8)②和⑥形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且⑥的质量分数约为70%.该化合物的化学式为S4N4.
(9)④和③两种元素形成含有非极性键的化合物化学式为Na2O2,鉴别该化合物中含④元素常用方法焰色反应;利用该化合物制取③单质的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
.元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
 .
.(3)②的最高价氧化物的化学式为N2O5写出其最高价氧化物的水化物稀溶液与足量的铁粉反应的离子方程式3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)表示①与⑦、①与⑥形成的化合物的电子式
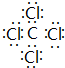 、
、 .
.(6)③、⑥氢化物的沸点高低H2O的沸点高于H2S;原因H2O分子之间存在氢键
(7)④、⑥、⑦形成的简单离子的半径大小S2->Cl->Na+
(8)②和⑥形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且⑥的质量分数约为70%.该化合物的化学式为S4N4.
(9)④和③两种元素形成含有非极性键的化合物化学式为Na2O2,鉴别该化合物中含④元素常用方法焰色反应;利用该化合物制取③单质的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
14.下列关于乙酸性质的叙述中,不正确的是( )
| A. | 纯净的乙酸又称为冰醋酸 | B. | 乙酸能与金属钠反应放出氢气 | ||
| C. | 乙酸的酸性比碳酸强 | D. | 乙酸与乙醇不互溶 |
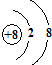 E的氢化物的分子式H2O.
E的氢化物的分子式H2O.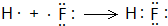 .
.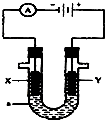 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: