题目内容
1.下列离子方程式正确的是( )| A. | 向Fe(NO3)3 溶液中滴入少量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 向AlCl3 溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Cu(OH)2沉淀溶于氨水得到深蓝色溶液:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O | |
| D. | 澄清石灰水中加入少量NaHCO3 溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
分析 A.少量KI,发生硝酸根离子与HI的反应;
B.一水合氨在离子反应中保留化学式;
C.反生成络离子;
D.反应生成碳酸钙、水、NaOH.
解答 解:A.向Fe(NO3)3 溶液中滴入少量的HI溶液的离子反应为2NO3-+8H++6I-=3I2+2NO↑+4H2O,故A错误;
B.向AlCl3 溶液中加入足量氨水的离子反应为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故B错误;
C.Cu(OH)2沉淀溶于氨水得到深蓝色溶液的离子反应为Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O,故C正确;
D.澄清石灰水中加入少量NaHCO3溶液的离子反应为Ca2++OH-+HCO3-═CaCO3↓+H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,选项C为解答的难点,题目难度不大.

练习册系列答案
相关题目
5.向含amol NaOH的溶液中通入bmol CO2,溶液中产生Na2CO3的物质的量为( )
①bmol ②amol ③0 ④(a-b)mol ⑤(a+b)mol.
①bmol ②amol ③0 ④(a-b)mol ⑤(a+b)mol.
| A. | ①⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③④ |
12.现有部分元素的性质与原子(或分子)结构如表所示:
(1)写出元素T的原子结构示意图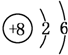 .
.
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式 .
.
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
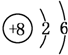 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式
 .
.
16.取相同物质的量浓度、相同体积的(NH4)3PO4,(NH4)2HPO4,NH4H2PO4种溶液,分别滴加NaOH溶液直至恰好完全反应,则3种溶液耗用NaOH溶液的体积之比是( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 1:1:1 | D. | 6:3:2 |
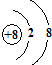 E的氢化物的分子式H2O.
E的氢化物的分子式H2O.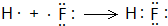 .
.