题目内容
15.如图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g)?xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系.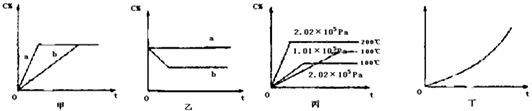
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则b曲线表示无催化剂时的情况,速率:a大于b(填:大于、小于或等于)
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则a曲线表示恒温恒容的情况,此时该恒温恒容中不变C%(填:变大、变小或不变)
(3)根据丙图可以判断该可逆反应的正反应是吸热反应(填:放热、吸热),计量数x的值是x>2(x为整数);
(4)丁图表示在某固定容器的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况,根据你的理解,丁图的纵坐标可以是①②③,[填:①C% ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)];升温平衡移动的方向为右移.(填:左移或右移)
分析 (1)催化剂改变反应历程,提高反应速率,缩短到达平衡的时间;有催化剂的反应速率快;
(2)恒温恒容下,充入不反应的气体,反应混合物各组分的浓度不变,平衡不移动,反应混合物各组分的含量不变,
恒温恒压下,充入不反应的气体,体积增大,反应混合物,各组分的浓度降低,等效为减小压强,平衡向气体体积增大的方向移动;
(3)采取控制变量法分析,由图可知,
压强相同时,温度越高,C的含量越高,即升高温度,平衡向正反应方向移动,升高温度,平衡向吸热方向移动;
温度相同,压强越大,平衡时C的含量越低,即增大压强,平衡向逆反应方向移动,增大压强平衡向体积减小的方向移动;
(4)根据(3)中可知该反应为吸热反应还是放热反应,升高温度,平衡向吸热方向移动.由图可知,纵轴所表示的量随温度升高而增大,根据平衡移动分析.
解答 解:(1)催化剂改变反应历程,提高反应速率,缩短到达平衡的时间,a曲线到达平衡时间短,b曲线到达平衡时间长,所以a曲线表示使用催化剂,b曲线未使用催化剂,有催化剂的反应速率快,所以速率:a 大于b,故答案为:b;大于;
(2)恒温恒容下,充入不反应的气体,反应混合物各组分的浓度不变,平衡不移动,反应混合物各组分的含量不变.由图可知,a曲线C的含量不变,b曲线到达新平衡后C的含量降低,所以a曲线表示恒温恒容条件下向平衡混合气体中充入He气,
故答案为:a;不变;
(3)由图可知,压强相同时,温度越高,C的含量越高,即升高温度,平衡向正反应方向移动,升高温度,平衡向吸热方向移动,所以正反应为吸热反应;
温度相同,压强越大,平衡时C的含量越低,即增大压强,平衡向逆反应方向移动,增大压强平衡向体积减小的方向移动,即x>2(x为整数),
故答案为:吸热;x>2(x为整数);
(4)该反应正反应为吸热反应,反应前后气体的体积增大.升高温度,平衡向吸热方向移动,即向右移动.
由图可知,纵轴所表示的量随温度升高而增大,升高温度,平衡向吸热方向移动,即向右移动,C的含量增大,A、B的转化率增大,平衡时A、B浓度降低.反应前后气体的体积增大,在恒容条件下,升高温度,平衡向吸热方向移动,即向右移动,混合物总的物质的量增加,所以平衡时,容器内压强增大,但起始压强 不为0,故①②③符合.
故答案为:①②③;右移.
点评 本题以图象为载体考查外界条件对平衡的影响,以及学生读图提取信息的能力,难度不大.

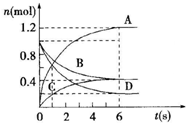 一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为3B+4D═6A+2C | |
| B. | 反应进行到6s时v(B)=v(C) | |
| C. | 反应进行到6s时,用B表示的平均反应速率为0.05mol•L-1•s-1 | |
| D. | 反应进行到6s时,反应停止了 |
| A. | AgNO3溶液 | B. | 稀硫酸 | C. | 稀盐酸 | D. | Ba(OH)2溶液 |
| A. | 该反应中铜单质在反应过程中得到电子 | |
| B. | 该反应中浓硝酸被氧化 | |
| C. | 该反应中硝酸只表现氧化性 | |
| D. | 该反应中浓硝酸是氧化剂 |
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏时,温度计水银球靠近蒸馏烧瓶的支管口处,且冷却水从冷凝管的上口通入下口流出 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 向1 mol•L-1氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体 |
| A. | 一小块钾投入冷水中:K+2H2O═K++2OH-+H2↑ | |
| B. | 氯气通入碘化钠溶液中:2I-+Cl2═I2+2Cl- | |
| C. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
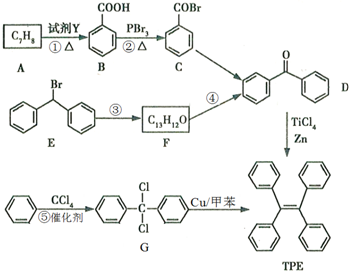
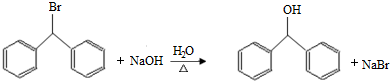 .
.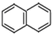 )的一元取代物;②能发生银镜反应.满足条件的W的结构简式共有4种(不考虑顺反异构).
)的一元取代物;②能发生银镜反应.满足条件的W的结构简式共有4种(不考虑顺反异构).