题目内容
4.在${\;}_{3}^{6}$Li、${\;}_{7}^{14}$N、${\;}_{11}^{23}$Na、${\;}_{12}^{24}$Mg、${\;}_{3}^{7}$Li、${\;}_{6}^{14}$C中:(1)${\;}_{3}^{6}$Li和${\;}_{3}^{7}$Li互为同位素.
(2)${\;}_{7}^{14}$N和${\;}_{6}^{14}$C质量数相等,但不能互称同位素.
(3)${\;}_{11}^{23}$Na和${\;}_{12}^{24}$Mg的中子数相等,但质子数不相等,所以不是同一种元素.
分析 (1)具有相同质子数,不同中子数同一元素的不同核素互为同位素;
(2)元素符号左上角的数字为质量数,左下角数字为质子数;
(3)元素就是具有相同的核电荷数(即核内质子数)的一类原子的总称,质量数=质子数+中子数.
解答 解:(1)${\;}_{3}^{6}$Li、${\;}_{3}^{7}$Li质子数都为3,中子数分别为3、4,互为同位素,
故答案为:${\;}_{3}^{6}$Li、${\;}_{3}^{7}$Li;
(2)${\;}_{7}^{14}$N、${\;}_{6}^{14}$C质子数分别为7、6,中子数分别为7、8,质量数都为14,质子数不同属于不同元素,不能互称同位素,
故答案为:${\;}_{7}^{14}$N、${\;}_{6}^{14}$C;
(3)${\;}_{11}^{23}$Na的中子数为23-11=12、${\;}_{12}^{24}$Mg的中子数为24-12=12,两者中子数相等,但质子数分别为11、12不相等,所以不是同一种元素,
故答案为:${\;}_{11}^{23}$Na、${\;}_{12}^{24}$Mg.
点评 本题主要考查了元素的种类、同位素的概念,题目难度中等,明确各基本概念及质子数、中子数、质量数之间的关系是解答关键,题目难度不大.

练习册系列答案
相关题目
9.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH?$C{H}_{3}CO{O}^{-}$+H+,要使溶液中c(H+)值增大,可以采取的措施是( )
| A. | 加少量烧碱溶液 | B. | 加蒸馏水 | ||
| C. | 加少量醋酸钠固体 | D. | 升高温度 |
16.下列化学用语表示正确的是( )
| A. | 氯化氢的电子式: | |
| B. | 乙烷的结构简式:C2H6 | |
| C. | 铝的原子结构示意图: | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++$S{{O}_{4}}^{2-}$ |
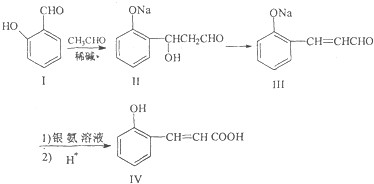
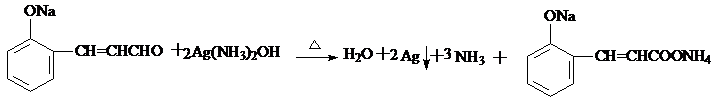 ;
;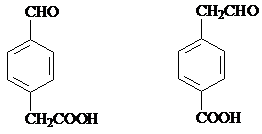 (只要求写出其中一种同分异构体)
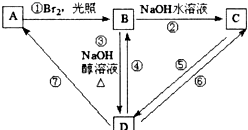
(只要求写出其中一种同分异构体) 经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为
经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为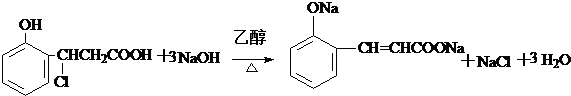 或
或 .
.
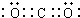 .
.
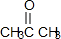 +2H2O;
+2H2O; .
.