题目内容
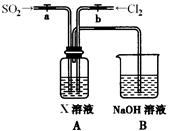
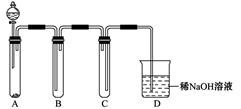
下图是一位学生设计的实验室制取和收集氯气并验证其性质的装置图。

(1)找出在此装置图中出现的错误加以改正。
(2)实验过程中,在D装置中观察到的实验现象是 ;在E装置中观察到的实验现象是 ,反应的化学方程式是 ;
(3)F装置的作用是 ,反应的离子方程式是 。

(1)找出在此装置图中出现的错误加以改正。
(2)实验过程中,在D装置中观察到的实验现象是 ;在E装置中观察到的实验现象是 ,反应的化学方程式是 ;
(3)F装置的作用是 ,反应的离子方程式是 。
(1)稀盐酸改用浓盐酸。B应在A的左边。C中进气管应该长,排气管应该短。(每空1分,共3分。)
(2)溶液先变红后褪色;(2分) 有白色沉淀生成,Cl2+H2O =HClO +HCl
HCl+AgNO3=AgCl↓ +HNO3(每个答案1分,共3分。写总反应、写离子方程式都可)。
(3)吸收多余的氯气,防止污染环境,(1分) Cl2+2OH—=ClO—+Cl—+H2O(2分)
(2)溶液先变红后褪色;(2分) 有白色沉淀生成,Cl2+H2O =HClO +HCl
HCl+AgNO3=AgCl↓ +HNO3(每个答案1分,共3分。写总反应、写离子方程式都可)。
(3)吸收多余的氯气,防止污染环境,(1分) Cl2+2OH—=ClO—+Cl—+H2O(2分)
试题分析:(1)观察装置图中试剂和仪器,出现的错误有:制取Cl2反应物为MnO2和浓盐酸,把装置图中的稀盐酸改为浓盐酸;应先用饱和食盐水除去HCl,再用浓硫酸除去H2O,所以B应在A的左边;Cl2的密度大于空气,收集时进气管应该长,排气管应该短。
(2)Cl2通入石蕊溶液,酸性使石蕊变化,Cl2与H2O反应生成的HClO具有漂白性,使石蕊褪色;Cl2与H2O反应生成的HCl与AgNO3反应生成白色AgCl沉淀,化学方程式有2个,首先是Cl2与H2O反应生成HCl和HClO,然后是HCl与AgNO3反应生成AgCl沉淀和HNO3。
(3)NaOH能与Cl2反应,所以NaOH溶液的作用是吸收多余的氯气,防止污染环境;Cl2与OH?反应生成Cl?、ClO?和H2O,配平可得离子方程式。2实验室制法的实验仪器和试剂及作用、实验现象的观察、方程式的书写。

练习册系列答案
相关题目
 MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O