题目内容
【题目】氢化阿托醛![]() 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下: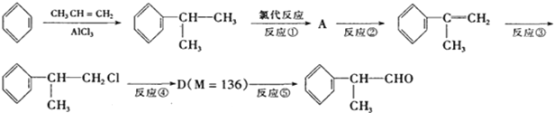
(1)氢化阿托醛被催化氧化后的含氧官能团的名称是____________.
(2)在合成路线上②③的反应类型分别为②_____________③________________.
(3)反应④发生的条件是_____________________.
(4)由![]() 反应的化学方程式为_______________________________
反应的化学方程式为_______________________________
(5)1mol氢化阿托醛最多可和____mol氢气加成,1mol氢化阿托醛发生银镜反应可生成________molAg.
(6)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为________.D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有______种.
【答案】羧基 消去反应 加成反应 NaOH水溶液、加热 ![]() 4 2 CH3COOH 6
4 2 CH3COOH 6
【解析】
由流程可知,苯和丙烯发生加成反应生异丙苯;异丙苯发生氯代反应生成A;A发生消去反应生成2-苯丙烯;2-苯丙烯再与氯化氢发生加成反应生成1-氯-2-苯丙烷;1-氯-2-苯丙烷发生水解反应生成2-苯-1-丙醇;2-苯-1-丙醇发生氧化反应生成氢化阿托醛。
(1)氢化阿托醛中的醛基被催化氧化为羧基,所以氢化阿托醛被氧化后的官能团是羧基;
(2)根据流程图可知,异丙苯发生氯代后生成的A中含有Cl原子,A发生消去反应生成烯烃,烯烃再与HCl发生加成反应生成卤代烃,所以②③的反应类型分别为消去反应、加成反应;
(3)D由卤代烃转化而来,其又发生反应转化为氢化阿托醛,官能团变为醛基,则D应是醇类,其被氧化得到醛,所以反应④应发生了卤代烃的水解反应,则其条件为NaOH的水溶液、加热;
(4)由D在Cu作催化剂、加热条件下与氧气发生氧化反应生成氢化阿托醛和水,化学方程式是![]() ;
;
(5)氢化阿托醛中的苯环和醛基均能与氢气发生加成反应,所以1mol氢化阿托醛最多与4mol氢气发生加成反应;
(6)D的相对分子质量是136,与X发生酯化反应生成相对分子质量为178的酯类物质,则X属于羧酸,根据质量守恒定律,该羧酸的相对分子质量是178+18-136=60,所以X是乙酸,结构简式为CH3COOH;D的同分异构体中,苯环有2个取代基,且苯环含有酚羟基的化合物中,2个取代基是酚羟基与丙基(或异丙基),这2个取代基在苯环上的排列方式有邻、间、对3种,所以符合题意的D的同分异构体有6种。

【题目】已知0.1mol/LH2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
①H2SO4溶液中的HSO | ②NaHSO4溶液中的HSO | ③CH3COOH | ④HCl溶液 |
10% | 29% | 1.33% | 100% |
(1)写出H2SO4在水中的电离方程式___。
(2)若将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,则混合后溶液中离子浓度由大到小顺序为___。
(3)根据题设条件计算CH3COOH的电离常数Ka=___。若常温下,将bmol·L–1的CH3COONa液与0.01mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka=___。