题目内容
【题目】某化学实验小组的同学为了探究SO2和氯水的漂白性,设计如下实验装置。
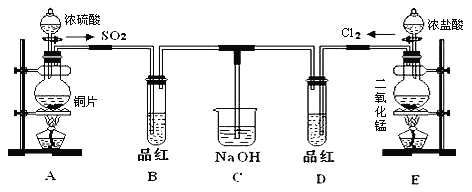
(1)写出A中反应的化学方程式__________,浓硫酸表现出__________性。
(2)实验室用装置E制备Cl2,离子方程式为:_____________该反应中的还原剂是_________(填化学式)。
(3)①装置A和E中,常用于萃取操作的仪器是__________(填名称)
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:__________,D:__________.
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未褪色,并且生成了两种常见的强酸,请你分析该现象的原因:__________________(用化学方程式表示)。
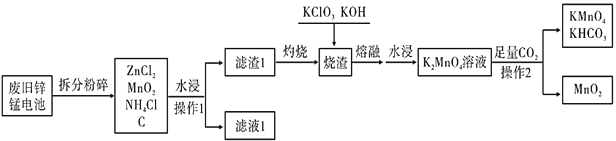
(5)第三个实验小组同学查阅资料得知:氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品及精制的流程:
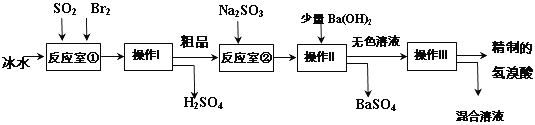
已知:Br 2是易挥发、深红棕色的液体,与Cl2化学性质相似;氢溴酸是易挥发、无色液体。
根据上述流程回答下列问题:
①反应室①使用冰水的目的___________。
②操作I的名称__________,操作Ⅱ的名称___________。
③反应室②中加入Na2SO3的目的是_____________。
④工业生产中制得的氢溴酸带有淡黄色。于是甲乙两同学设计了实验加以探究:
A.甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为_____________,若假设成立可观察到的现象为___________。
B.乙同学假设工业氢溴酸呈淡黄色是因为___________,其用于证明该假设成立的方法为____________。
【答案】Cu + 2H2SO4(浓)![]() CuSO4+ SO2↑+ 2H2O 酸性、强氧化性 MnO2+4H++2Cl—
CuSO4+ SO2↑+ 2H2O 酸性、强氧化性 MnO2+4H++2Cl—![]() Mn2++Cl2↑+2H2O HCl 分液漏斗 变红 不变色 SO2+Cl2+2H2O ==2HCl+H2SO4 降低体系温度,防止Br2挥发,使反应进行完全 蒸馏 过滤 除去粗产品中的Br2 KSCN 溶液变为血红色 溶解了少量Br2 加入CCl4进行萃取,若观察CCl4中有橙红色液体出现,可证明
Mn2++Cl2↑+2H2O HCl 分液漏斗 变红 不变色 SO2+Cl2+2H2O ==2HCl+H2SO4 降低体系温度,防止Br2挥发,使反应进行完全 蒸馏 过滤 除去粗产品中的Br2 KSCN 溶液变为血红色 溶解了少量Br2 加入CCl4进行萃取,若观察CCl4中有橙红色液体出现,可证明
【解析】
(1)在A中,Cu与浓硫酸混合加热发生反应产生硫酸铜、二氧化硫和水,反应的化学方程式Cu + 2H2SO4(浓)![]() CuSO4+ SO2↑+ 2H2O;在该反应中浓硫酸表现出酸性和强的氧化性。
CuSO4+ SO2↑+ 2H2O;在该反应中浓硫酸表现出酸性和强的氧化性。
(2)实验室用MnO2与浓盐酸混合加热制取Cl2,反应的离子方程式为MnO2+ 4H++ 2Cl—![]() Mn2++ Cl2↑+ 2H2O;在该反应中的还原剂是浓盐酸,化学式是HCl。
Mn2++ Cl2↑+ 2H2O;在该反应中的还原剂是浓盐酸,化学式是HCl。
(3)①装置A和E中,常用于萃取操作的仪器是分液漏斗;②停止通气后,再给B、D两个试管分别加热,由于SO2的漂白是结合漂白,产生的无色物质不稳定,受热分解,使物质恢复原来的颜色,而氯气与水发生反应产生的HClO的漂白是氧化漂白,产生的物质结构稳定,加热也不能分解而使其恢复原来的颜色,故两个试管中的现象分别为B:变红,D:不变色;
(4)将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未褪色,并且生成了两种常见的强酸,用化学方程式表示反应原理是:SO2+ Cl2+ 2H2O = 2HCl + H2SO4;
(5)①在反应室中发生反应:SO2+ Br2+ 2H2O =2HBr+ H2SO4,使用冰水的目的是降低体系温度,防止Br2挥发,使反应进行完全;
②操作I是分离互溶的沸点不同的液体混合物的方法,名称是蒸馏;操作Ⅱ是分离难溶性的固体与可溶性的液体混合物的方法,名称是过滤;
③反应室②中加入Na2SO3具有还原性,可以将未反应的Br2还原为HBr,除去粗产品中的Br2;
④A.甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 KSCN溶液,若假设成立,二者会发生反应产生Fe(SCN)3,使溶液变为血红色;
B.乙同学假设工业氢溴酸呈淡黄色是因为少量Br2;用于证明该假设成立的方法可根据Br2容易溶解在有机物中,根据有机溶剂的颜色的不同鉴定,加入CCl4进行萃取,若观察CCl4中有橙红色液体出现,可证明含有Br2。

【题目】某实验探究小组研究320K时![]() 的分解反应:
的分解反应:![]() 。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
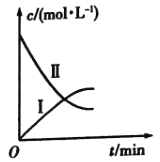
t/min | 0 | 1 | 2 | 3 | 4 |
| 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
| 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.曲线Ⅰ是![]() 的浓度变化曲线
的浓度变化曲线
B.曲线Ⅱ是![]() 的浓度变化曲线
的浓度变化曲线
C.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
D.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快