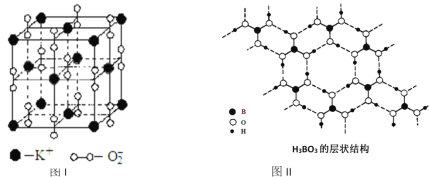
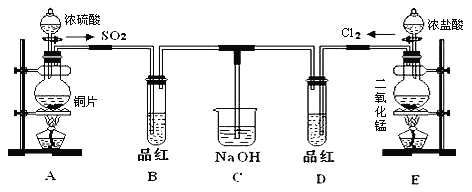
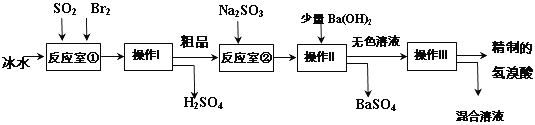
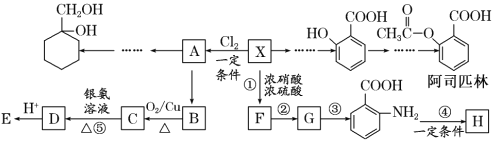
题目内容
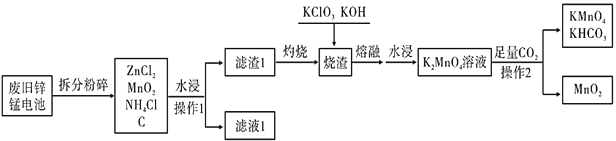
【题目】KMnO4是一种重要的消毒剂,俗名灰锰氧。某工厂以废旧的锌锰干电池为原料制备高锰酸钾的流程如下(各部分产物已省略):
(1)这种锌锰电池放电时,负极的电极反应是_______________________________。
(2)滤渣1灼烧的目的是______________________________;可循环利用的物质是_________________(填化学式)。
(3) “水浸”采用适当加热,搅拌等措施,其目的是_________________________。熔融滤渣可能产生大气污染物是________________(填化学式) 。
(4)向![]() 溶液中通入足量CO2的离子方程式:_______________________。
溶液中通入足量CO2的离子方程式:_______________________。
(5)工业上,以石墨为电极电解K2MnO4溶液制备KMnO4,阳极的电极反应式为______________________。
【答案】![]() 除去碳粉
除去碳粉 ![]() 提高水浸速率和浸取率
提高水浸速率和浸取率 ![]()
![]()
![]()
【解析】
废旧锌锰电池的成分已给出,水浸后分成了滤液和滤渣,则操作I是过滤,得到的是氯化锌和氯化铵溶液,沉淀中有碳粉和二氧化锰,灼烧滤渣I的过程中,碳转变为二氧化碳逸出,烧渣再与氯酸钾、氢氧化钾熔融条件下反应,得到锰酸钾,通入足量的二氧化碳后,+6价的锰发生歧化反应,一部分变成+4价的二氧化锰沉淀,一部分变成+7价的高锰酸钾,则操作2仍然是过滤,据此来分析本题即可。
(1)电池中有![]() ,因此是酸性锌锰干电池,表面的锌皮作负极,负极反应为
,因此是酸性锌锰干电池,表面的锌皮作负极,负极反应为![]() ;
;
(2)根据分析,灼烧的目的是除去混合物中的碳粉,最后经操作2过滤后可以得到![]() ,这些
,这些![]() 可以循环利用;
可以循环利用;
(3)加热和搅拌,都是常见的加速溶解的措施,因此答案为提高水浸速率和可溶物的浸取率,在反应中![]() 作氧化剂被还原,因此有可能被还原为
作氧化剂被还原,因此有可能被还原为![]() ,
,![]() 可造成大气污染;
可造成大气污染;
(4)注意![]() 不参与氧化还原反应,仅仅是锰元素的歧化,写出离子方程式:
不参与氧化还原反应,仅仅是锰元素的歧化,写出离子方程式:![]() ;
;
(5)由![]() 到
到![]() 需要失电子,而电解池的阳极发生的就是失电子反应,因此阳极反应式为:
需要失电子,而电解池的阳极发生的就是失电子反应,因此阳极反应式为:![]() 。
。

【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
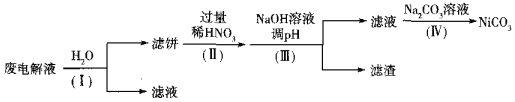
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。