题目内容
【题目】利用硫酸渣(主要含Fe2O3、SiO2)制备纳米Fe3O4的工艺流程如下:
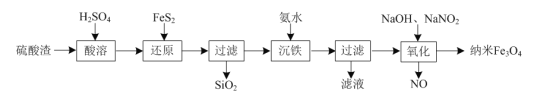
(1)“还原”时FeS2被氧化为SO![]() ,该反应的离子方程式为:_____。
,该反应的离子方程式为:_____。
(2)“沉铁”过程中的离子反应方程式为:______。
(3)“氧化”过程中的离子方程式为:________。
(4)一定条件下以Fe片作阳极、石墨作阴极电解NaCl溶液也可制得纳米Fe3O4,写出该反应的化学方程式:_________。
(5)有氧条件下,NO可被NH3催化还原为N2和H2O。当n(NO)∶n(O2)=4∶1时,该反应的化学方程式:_________。
【答案】14Fe3++FeS2+8H2O=15Fe2++2SO![]() +16H+ Fe2++2NH3·H2O=Fe(OH)2↓+2NH
+16H+ Fe2++2NH3·H2O=Fe(OH)2↓+2NH![]() 3Fe(OH)2+2NO
3Fe(OH)2+2NO![]() =Fe3O4+2NO↑+2OH﹣+2H2O 3Fe+4H2O
=Fe3O4+2NO↑+2OH﹣+2H2O 3Fe+4H2O![]() Fe3O4+4H2↑ 4NH3+4NO+O2
Fe3O4+4H2↑ 4NH3+4NO+O2 4N2+6H2O
4N2+6H2O
【解析】
(1)Fe3+被FeS2还原为Fe2+,FeS2被氧化生成SO![]() ,则该反应的离子方程式为:14Fe3++FeS2+8H2O=15Fe2++2SO
,则该反应的离子方程式为:14Fe3++FeS2+8H2O=15Fe2++2SO![]() +16H+,故答案为:14Fe3++FeS2+8H2O=15Fe2++2SO
+16H+,故答案为:14Fe3++FeS2+8H2O=15Fe2++2SO![]() +16H+;
+16H+;
(2)“沉铁”过程是硫酸亚铁与氨水生成氢氧化铁沉淀,离子方程式为Fe2++2NH3·H2O=Fe(OH)2↓+2NH![]() ,故答案为:Fe2++2NH3·H2O=Fe(OH)2↓+2NH
,故答案为:Fe2++2NH3·H2O=Fe(OH)2↓+2NH![]() ;
;
(3)“氧化”过程是氢氧化亚铁与亚硝酸钠的反应生成四氧化铁、一氧化氮、氢氧化钠和水,离子方程式为:3Fe(OH)2+2NO![]() =Fe3O4+2NO↑+2OH﹣+2H2O,故答案为:3Fe(OH)2+2NO
=Fe3O4+2NO↑+2OH﹣+2H2O,故答案为:3Fe(OH)2+2NO![]() =Fe3O4+2NO↑+2OH﹣+2H2O;
=Fe3O4+2NO↑+2OH﹣+2H2O;
(4)Fe作阳极,失电子化合价升高,阴极上氢离子得电子生成氢气,总反应为3Fe+4H2O![]() Fe3O4+4H2↑,故答案为:3Fe+4H2O
Fe3O4+4H2↑,故答案为:3Fe+4H2O![]() Fe3O4+4H2↑
Fe3O4+4H2↑
(5)根据题干信息反应物为NH3、NO、O2,生成物为N2、H2O,根据电子转移守恒配平得反应方程式为:4NH3+4N+O2 4N2+6H2O,故答案为:4NH3+4NO+O2
4N2+6H2O,故答案为:4NH3+4NO+O2 4N2+6H2O。
4N2+6H2O。

 小题狂做系列答案
小题狂做系列答案【题目】滴定实验是化学学科中重要的定量实验。请回答下列问题:
I.酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
(1)该学生的实验操作如下:
a.用碱式滴定管取稀NaOH 25.00 mL,注入锥形瓶中,加入甲基橙作指示剂。
b.用待测定的溶液润洗碱式滴定管。
c.用蒸馏水洗干净滴定管。
d.取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3 cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
e.检查滴定管是否漏水。
f.另取锥形瓶,再重复操作一次。
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)___________________。
②某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
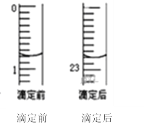
仪器A的名称是_____________;盐酸的体积读数:滴定前读数为____mL,滴定后读数为____mL;
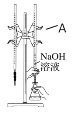
③在g操作中如何确定终点________________。
(2)下列操作造成测定结果偏高的是______(填选项字母)。
A.滴定终点时,俯视滴定管溶液液面
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
II.氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1 mol/L的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
(1)滴定时,KMnO4溶液应装在___(“酸”或“碱”)式滴定管中,滴定终点时锥形瓶内的颜色变化是___。
(2)该草酸溶液的物质的量浓度为__________。