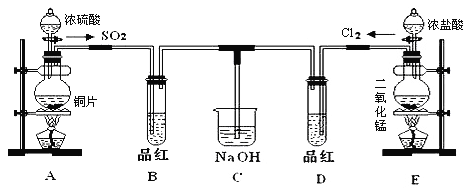
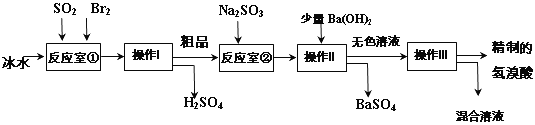
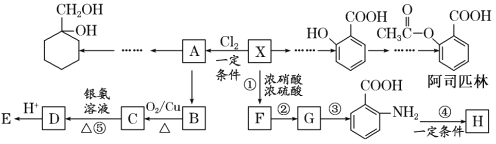
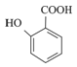
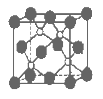
题目内容
【题目】下列指定反应的离子方程式正确的是
A.用醋酸溶解大理石:CaCO3+2H+=Ca2++H2O+CO2↑
B.向氨水中通入足量SO2气体:SO2+NH3·H2O=NH![]() +HSO
+HSO![]()
C.FeO溶于稀硝酸:FeO+2H+=Fe2++H2O
D.电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
【答案】B
【解析】
A. 醋酸为弱酸,反应的离子方程式为:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑,故A错误;
B. 向氨水中通入足量SO2气体反应生成亚硫酸铵,离子方式为:SO2+NH3·H2O=NH![]() +HSO
+HSO![]() ,故B正确;
,故B正确;
C. 稀硝酸有强氧化性,反应生成Fe3+,离子方程式为:3FeO+10H++NO3-=3Fe3++NO↑+5H2O,故C错误;
D. 电解氯化镁溶液生成氢气、氯气和氢氧化镁沉淀,离子方程式为:2Cl-+Mg2++2H2O![]() Cl2↑+H2↑+Mg(OH)2↓,故D错误;
Cl2↑+H2↑+Mg(OH)2↓,故D错误;
故选B。

【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
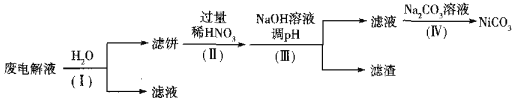
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。