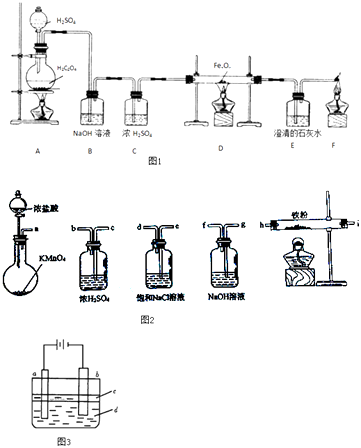
题目内容
【题目】如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: 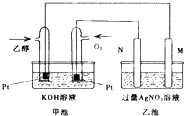
(1)M电极的材料是 , 电极名称是 , 加入乙醇的铂电极的电极反应式为 .
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为mL(标准状况下).
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量表示该反应的热化学方程式为 .
【答案】
(1)铁;阴极;C2H5OH﹣12e﹣+16OH﹣=2CO32﹣+11H2O
(2)224
(3)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l),△H=﹣1366.7kJ/mol
【解析】解:(1)碱性乙醇燃料电池中通入乙醇的一极为原电池的负极,负极上乙醇失电子发生氧化反应,电极反应式为C2H5OH﹣12e﹣+16OH﹣=2CO32﹣+11H2O,通入氧气的一极为原电池的正极,电极反应式为:4OH﹣﹣4e﹣═2H2O+O2↑,乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为石墨材料,N为阳极,电极反应式是4OH﹣﹣4e﹣=O2↑+2H2O,M为阴极,电极材料是Fe, 所以答案是:铁;阴极;C2H5OH﹣12e﹣+16OH﹣=2CO32﹣+11H2O;(2)n(Ag)= ![]() =0.04mol,根据Ag++e﹣=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e﹣=4H2O,则消耗n(O2)=
=0.04mol,根据Ag++e﹣=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e﹣=4H2O,则消耗n(O2)= ![]() ×0.04mol=0.01mol,V(O2)=0.01mol×22.4L/mol=0.224L=224mL,
×0.04mol=0.01mol,V(O2)=0.01mol×22.4L/mol=0.224L=224mL,
所以答案是:224;(3)常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量表示该反应的热化学方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l),△H=﹣1366.7kJ/mol.
所以答案是:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l),△H=﹣1366.7kJ/mol.

 名校课堂系列答案
名校课堂系列答案【题目】某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO47H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%). 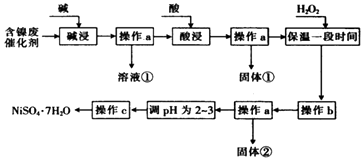
部分阳离子以氢氧化物形式沉淀时的pH如表:
沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
Al(OH)3 | 3.8 | 5.2 |
Fe(OH)3 | 2.7 | 3.2 |
Fe(OH)2 | 7.6 | 9.7 |
Ai(OH)2 | 7.1 | 9.2 |
(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是(填化学式).
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是 .