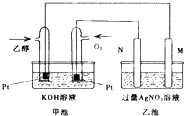
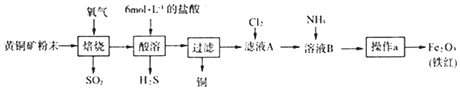
题目内容
【题目】现有250mL浓度为2.0mol/L的硫酸和含1mol氢氧化钠的溶液,足量的铝屑.用上述原料生产Al(OH)3的量最多时消耗铝的质量为( )
A.26g
B.36g
C.104g
D.37.8g
【答案】B
【解析】解:根据金属铝和酸以及和碱发生反应的化学方程式可以得出:Al~3H+~Al3+~ ![]() H2SO4~Al(OH)3 , Al~OH﹣~NaOH~[Al(OH)4]﹣ , 由可知Al3++3[Al(OH)4]﹣=4Al(OH)3↓,Al3+~3[Al(OH)4]﹣~
H2SO4~Al(OH)3 , Al~OH﹣~NaOH~[Al(OH)4]﹣ , 由可知Al3++3[Al(OH)4]﹣=4Al(OH)3↓,Al3+~3[Al(OH)4]﹣~ ![]() H2SO4~3NaOH~4Al(OH)3↓,所以
H2SO4~3NaOH~4Al(OH)3↓,所以
| ~ | 3NaOH | ~ | 4Al(OH)3↓ |
| 3 | 4 | ||
0.25L×2.0mol/L=0.5mol | 1mol |
0.25L×2.0mol/L=0.5mol 1mol
经比较硫酸和氢氧化钠确好完全反应,所以根据铝原子守恒,则最多时消耗铝的质量为: ![]() mol×27g/mol=36g,故选B.
mol×27g/mol=36g,故选B.

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 直到为止.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
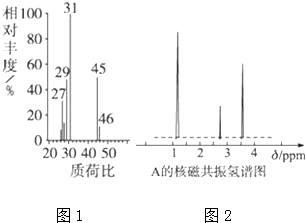
(3)若滴定开始和结束时,酸式滴定管中的液面如图1和图2所示,请将数据填入表格的空白处.
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(4)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= .