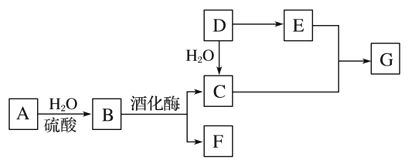
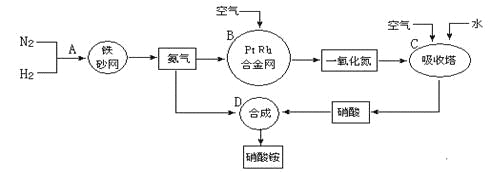
题目内容
【题目】已知断开1molH-H键吸收的能量为436kJ,形成1molN-H键放出的能量为391kJ,根据化学方程式N2+3H2![]() 2NH3可知,高温、高压条件下,1molN2完全反应放出的能量为92.4kJ,则断开1molN
2NH3可知,高温、高压条件下,1molN2完全反应放出的能量为92.4kJ,则断开1molN![]() N键吸收的能量是( )
N键吸收的能量是( )
A.431kJB.649kJC.869kJD.945.6kJ
【答案】D
【解析】
已知H-H键的键能为436kJ/mol,N-H键的键能为391kJ/mol,设N≡N键的键能为x,题述反应放出的热量=生成物的总键能—反应物的总键能,即6mol×391kJ/mol-3mol×436kJ/mol-1molx=92.4kJ,x=945.6kJ/mol,从而得出断开1molN![]() N键吸收的能量是945.6kJ,故选D。
N键吸收的能量是945.6kJ,故选D。

【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
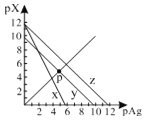
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
【题目】下列有关实验操作,现象和解释或结论都正确的是
| 操作 | 现象 | 解释或结论 |
A | 向某溶液中通入Cl2,再加入CCl4、振荡,静置 | 溶液分层,上层呈紫色 | 说明溶液中含有I- |
B | 向Fe(NO3)2溶液加入盐酸酸化的KSCN溶液 | 溶液变成血红色 | Fe(NO3)2已经变质 |
C | FeCl3溶液加入过量的KI溶液,再加入KSCN溶液 | 溶液变成血红色 | Fe3+与I-反应为可逆反应 |
D | 向玻璃片上分别滴几滴氢氟酸和NaOH溶液 | 玻璃片慢慢被腐蚀 | SiO2是两性氧化物能与酸、碱反应 |
A.AB.BC.CD.D